
| A. | 碳酸钠溶液与稀盐酸混合 | B. | 硫酸钠溶液与氯化钾溶液混合 | ||
| C. | 稀硫酸与氢氧化钠溶液混合 | D. | 氢氧化钠溶液与硫酸铜溶液混合 |
科目:高中化学 来源: 题型:解答题
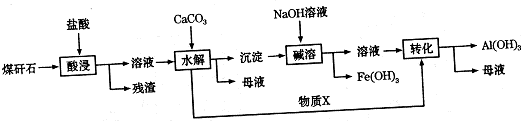
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够和氯气发生加成反应 | |
| D. | 丙烷的熔点比乙烷高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

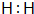 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 离子方程式或电极反应式 | 评价 | |
| A | 次氯酸钙溶液中通入足量SO2 | Ca2++C1O-+SO2+H2O=CaSO4+ C1-+2H+ | 正确 |
| B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-= Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4+?CH3COOH+NH3•H2O | 错误,阴离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e-=2Cu 阳极:4OH--4e-=2H2O+O2↑ | 错误,该阴阳两极反应不可能同时发生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com