
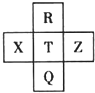
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | X最高价氧化物的水化物的表达式为H2XO4 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | R与Q的电子数相差26 |
分析 R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素,据此结合元素周期律知识进行解答.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素,
A.Z为Ar元素,最外层为稳定结构,金属性与非金属性在同周期中最弱,同周期自左而右金属性减弱,故非金属性Z<X<T,故A错误;
B.X为S元素,S的最高价氧化物的水化物的表达式为H2SO4,故B正确;
C.同主族自上而下,非金属性减弱,故非金属性F>Cl>Br,非金属性越强,气态氢化物越稳定,故稳定性:HF>HCl>HBr,故C错误;
D.R为F元素,Q为Br元素,二者的原子序数相差为26,故D正确;
故选BD.
点评 本题考查原子结构与元素周期律的综合应用,题目难度中等,推断R为氟元素是关键,注意掌握元素周期律内容、元素周期表结构,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{W+n}$(N-m)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④⑤ | C. | ①②④ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2溶于水的过程中有1NA个电子转移 | |
| B. | 标准状况下,22.4L NO2气体中含有NA个O2分子 | |
| C. | 常温常压下,15g HCHO含有2NA对共用电子对 | |
| D. | 1L 0.1mol•L-1的醋酸溶液中有NA个CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐类的水解过程破坏了纯水的电离平衡 | |
| B. | 盐类的水解是酸碱中和反应的逆反应 | |
| C. | 盐类的水解的结果使盐溶液不一定呈中性 | |
| D. | K2S溶液中,c(K+)是c(S2-)的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com