
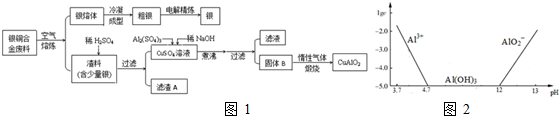
分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;在硫酸铜溶液中加入硫酸铝、氢氧化钠,煮沸、过滤得到Al(OH)3和CuO,灼烧中会得到CuO、Al2O3,二者煅烧可得到CuAlO2,滤渣A含有Ag,粗银电解时,粗银为阳极,在阴极上得到银,可得到提纯的目的,
(1)根据电解原理分析判断,电镀法精炼银时,粗银为阳极,精银为阴极;
(2)依据图象和溶度积常数计算铜离子和铝离子完全沉淀所需的PH,未煮沸之前是Cu(OH)2和Al(OH)3,Cu(OH)2分解的温度为80℃判断产物,根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算.
解答 解:(1)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag,
故答案为:阳;Ag++e-=Ag;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO,在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在铝离子和铜离子全部沉淀,氢氧化铝沉淀完全PH=12,室温时,Cu(OH)2的溶度积Ksp=2.0×10-20.(lg5=0.7),据此计算全部沉淀的PH,c2(OH-)=$\frac{2×1{0}^{-20}}{1×1{0}^{-5}}$=2×10-15,c(H+)=10-6.65,PH=6.65,在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在为:6.65-12,氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:6.65-12; Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:4CuO+2Al2O3=4CuAlO2+O2↑;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=$\frac{1000g×64%}{64g/mol}$=10.0mol,则CuAlO2为10.0mol,
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×$\frac{1}{2}$=5.0mol,所以需要体积为$\frac{5mol}{1.0mol/L}$=5L,
故答案为:5;
点评 本题以从废料中回收银并制备铜化工产品为背景,考查了物质制备原理及其应用,题目难度中等,涉及电解原理、沉淀的判断、氧化还原反应的配平以及化学计算等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: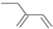 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
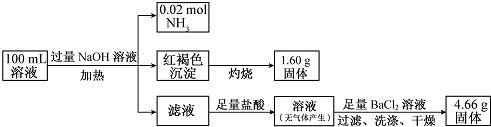
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com