
①当x≤0.5n mol时,这一反应的离子方程式是____________________________________。
②当x≥1.5n mol时,这一反应的离子方程式是____________________________________。
③当x=n mol时,这一反应的离子方程式是________________________________________。
(2)①向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:____
________________________________________________________________。
②在以上中性溶液中,继续滴入Ba(OH)2溶液,请写出此步反应的离子方程式:___________
____________________________________。
解析:本题考查灵活书写离子方程式的能力。(1)FeBr2溶液中的Br-和Fe2+都具有还原性,但是在溶液中,两者的还原能力并不相同,Fe2+的还原能力强于Br-,所以当加入的氧化剂的量不足时,是还原能力强的Fe2+先失电子。当x≤0.5n mol时,只由Fe2+提供电子就够了;当x≥1.5n mol时,两种还原性的离子完全被氧化;当x=n mol时,是全部的Fe2+和一半的Br-提供电子。
(2) ①题目要求NaHSO4溶液与Ba(OH)2溶液反应呈中性,也即要求写出的离子方程式属于下列反应:2NaHSO4+Ba(OH)2![]() 2H2O+BaSO4↓+Na2SO4。而不是属于下列反应:NaHSO4+Ba(OH)2
2H2O+BaSO4↓+Na2SO4。而不是属于下列反应:NaHSO4+Ba(OH)2![]() H2O+BaSO4↓+NaOH。
H2O+BaSO4↓+NaOH。
因此上述反应的离子方程式可以写成2![]() +Ba2++2OH-
+Ba2++2OH-![]() 2H2O+BaSO4↓+
2H2O+BaSO4↓+![]() 或2H++
或2H++![]() +Ba2++2OH-
+Ba2++2OH-![]() 2H2O+BaSO4↓,从此可知,反应后的中性溶液中有一定量的
2H2O+BaSO4↓,从此可知,反应后的中性溶液中有一定量的![]() 存在。
存在。
②若向上述反应后的中性溶液中,继续滴加Ba(OH)2溶液,则只有![]() 与Ba2+发生反应生成白色沉淀:
与Ba2+发生反应生成白色沉淀:![]() +Ba2+
+Ba2+![]() BaSO4↓。
BaSO4↓。
答案:(1)①2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
②2Fe2++4Br-+3Cl2![]() 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
③2Fe2++2Br-+2Cl2![]() 2Fe3++Br2+4Cl-
2Fe3++Br2+4Cl-
(2) ①2![]() +Ba2++2OH-
+Ba2++2OH-![]() 2H2O+BaSO4↓+
2H2O+BaSO4↓+![]() 或2H++
或2H++![]() +Ba2++2OH-
+Ba2++2OH-![]() 2H2O+ BaSO4↓ ②
2H2O+ BaSO4↓ ②![]() +Ba2+
+Ba2+![]() BaSO4↓
BaSO4↓


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)当x≤0.5n mol时,这一反应的离子方程式是 。
(2)当x≥1.5n mol时,这一反应的离子方程式是 。
(3)当x=n mol时,这一反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有n mol FeBr2的溶液中,通入的Cl2的物质的量为x。
(1)当x≤0.5n mol时,这一反应的离子方程式是 。
(2)当x≥1.5n mol时,这一反应的离子方程式是 。
(3)当x=n mol时,这一反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:选择题
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )
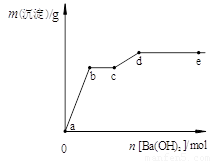
A、a→b时的沉淀的成分为BaSO4与Mg(OH)2
B、b→c时发生的离子反应为:H+ + OH— → H2O
C、c→d时离子的物质的量:Ba2+ 可能大于Cl—
D、d→e时离子的物质的量:Ba2+ 一定大于OH—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com