
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(E)的热化学方程式__________________。
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议___________________。

(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。
①SCR技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
②SCR技术的另一主要反应为4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。

①写出该脱硝原理总反应的化学方程式______________________。
②为达到最佳脱硝效果,应选择的条件是______________________。
【答案】2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= -746.5kJ·mol-1 减少机动车有害尾气的排放 ![]() < 4NH3+7O2
< 4NH3+7O2 ![]() 4NO2+6H2O 6NO+3O2+ 2C2H4
4NO2+6H2O 6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O 约为350℃、负载率3.0 %
3N2+4CO2+4H2O 约为350℃、负载率3.0 %
【解析】
(1)①已知:(1)![]() ═
═![]()
(2)![]() ═
═![]()
(3)![]() ═
═![]()
根据盖斯定律,(3)![]() 可得:
可得:![]() ,故
,故![]() ,
,
反应热化学方程式为:![]() ,
,
因此,本题正确答案是:![]() .
.
②由图可知,随着时间的加长,烃类、氮的氧化物逐渐转化为醛、PAN、臭氧,会形成光化学烟雾,减少光化学烟雾的发生,可减少氮的氧化物的排放,如减少汽车尾气的排放。
(2)①SCR技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K= ![]() ,因为该反应的平衡常数K随温度T的升高而减小,所以△H. <0 。本题答案:. < 。
,因为该反应的平衡常数K随温度T的升高而减小,所以△H. <0 。本题答案:. < 。
②反应![]()
![]() 是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,反应方程式:4NH3+7O2
是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,反应方程式:4NH3+7O2 ![]() 4NO2+6H2O因此,本题正确答案是:温度升高,发生了副反应:
4NO2+6H2O因此,本题正确答案是:温度升高,发生了副反应:![]() ═
═![]() ;温度升高,
;温度升高,
(3)根据图1可以知道,在催化剂的作用下,![]() 与NO、
与NO、![]() 反应最终生成
反应最终生成![]() 、
、![]() 、
、![]() ,反应总方程式为6NO+3O2+ 2C2H4
,反应总方程式为6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O:,
3N2+4CO2+4H2O:,
因此,本题正确答案是: 6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O;
3N2+4CO2+4H2O;
(2)由图可以知道,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为![]() 、负载率3%,因此,本题正确答案是:
、负载率3%,因此,本题正确答案是:![]() 、负载率
、负载率![]() .
.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
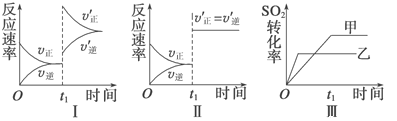
A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下广告语中,符合科学道理的是( )
A.“超纯净水”绝对卫生,对人有益
B.含碘食盐可以防治甲状腺肿大
C.无糖饼干中不含糖类物质
D.本饮料由纯天然物质配成,绝对不含化学物质,对人无害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)为原料获得。有关工艺流程如下:

注:(1)NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀。
(2)25℃,Ksp[Fe(OH)3]=2.64×10-39;溶液中离子浓度小于10-5mol·L-1,可视为沉淀完全。
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________。(任写一点)
(2)在滤液Ⅱ中加入H2O2时,温度不能太高的原因是______________________。
(3)滤液Ⅲ中溶质的主要成分是__________________ ,检验滤液Ⅲ中是否还有铁元素的方法是_______________________。
(4)除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法正确的是__________________(选填序号)。

a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-27mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右
(5)从“沉淀A”制得NiSO4·6H2O晶体的实验步骤依次为:_________________,用少量乙醇洗涤NiSO4·6H2O晶体并晾干。(实验中须使用的试剂有:6mol·L-1的H2SO4溶液,蒸馏水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其合金是人类最早使用的金属材料。
(1)基态铜原子的电子排布式为___________________。
(2)图1是Cu2O的晶胞,Cu原子配位数为_________________。

(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可表示如图2。
①SO42-中S原子的杂化类型为________________,写出一个与SO42-互为等电子体的分子的化学式____________________。
②胆矾的化学式用配合物的形式可表示为_______________。1mol胆矾所含σ键的数目为:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 2 L 0.5 mol·L-1CH3COOH溶液中,CH3COO- 的数目为NA
B. 一定质量的某单质,若含质子数为n NA,则中子数一定小于nNA
C. 标准状况下,22.4LHF含有的共价键数为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:

①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com