
【题目】无机或有机含氧酸分子去掉一个或多个羟基后剩余结构称为酰基,如“—SO2—”称为硫酰(基),SOCl2、SO2Cl2、COCl2分别称为亚硫酰氯、硫酰氯和碳酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸、都可作氯化剂等。回答下列问题:
(1)已知:SO2(g)+PCl5(s) ![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
PCl5(s)+H2O(l) ![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
则反应SOCl2(l)+H2O(l) ![]() SO2(g)+2HCl(g) ΔH3=________kJ·mol1(用含a、b的代数式表示)。
SO2(g)+2HCl(g) ΔH3=________kJ·mol1(用含a、b的代数式表示)。

(2)在1 L的密闭容器中充入1 mol SO2和2 mol Cl2,发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(l),达平衡后,其他条件不变,减小压强,请在图中画出改变条件后反应速率随时间的变化曲线图。再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为___________g。
SO2Cl2(l),达平衡后,其他条件不变,减小压强,请在图中画出改变条件后反应速率随时间的变化曲线图。再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为___________g。
(3)一定条件下存在反应:CO(g)+Cl2(g) ![]() COCl2(g) ΔH=108 kJ·mol1,现有3个体积均为10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在150℃条件下开始反应达平衡。
COCl2(g) ΔH=108 kJ·mol1,现有3个体积均为10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在150℃条件下开始反应达平衡。
1 mol CO、1 mol Cl2 |
Ⅰ绝热恒容
1 mol COCl2 |
Ⅱ恒温恒容
1 mol CO、1 mol Cl2 |
Ⅲ恒温恒容
①容器Ⅰ中CO的转化率与容器Ⅱ中COCl2的转化率之和_________(填“>”“<”或“=”)1。②容器Ⅲ中反应前总压强为1 atm,反应后的总压强为0.75 atm,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1)ba
(2)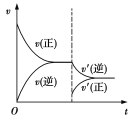 233 (3)①< ② 4 atm1
233 (3)①< ② 4 atm1
【解析】(1)SO2(g)+PCl5(s)![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1 ①
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1 ①
PCl5(s)+H2O(l)![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1 ②
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1 ②
反应①反应②得SO2(g)+2HCl(g) ![]() SOCl2(l)+H2O(l),ΔH=ΔH1ΔH2=(ab) kJ·mol1。因此有ΔH3=(ΔH1ΔH2)=(ba) kJ·mol1。
SOCl2(l)+H2O(l),ΔH=ΔH1ΔH2=(ab) kJ·mol1。因此有ΔH3=(ΔH1ΔH2)=(ba) kJ·mol1。
(2)由于生成物中只有液态的SO2Cl2,因此减小压强的瞬间逆反应速率不变,正反应速率减小,平衡逆向移动。反应后注入足量BaCl2溶液的过程中发生的相关反应有SO2Cl2+2H2O![]() H2SO4+2HCl,SO2+Cl2+2H2O
H2SO4+2HCl,SO2+Cl2+2H2O![]() H2SO4+2HCl,H2SO4+BaCl2
H2SO4+2HCl,H2SO4+BaCl2![]() BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。
BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。
(3)①若装置Ⅰ为恒温恒容,则转化率之和等于1,由于装置Ⅰ绝热,而该反应是放热反应,随着反应进行温度升高不利于CO转化,因此两者之和小于1。 ②根据压强之比等于物质的量之比可知反应后容器内气体的物质的量为1.5 mol,可知平衡后n(CO)=n(Cl2)= n(COCl2)= 0.5 mol,平衡分压各为0.25 atm,Kp=![]() =4 atm1。
=4 atm1。


科目:高中化学 来源: 题型:
【题目】臭氧(O3)在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t如下表所示。己知:O3的起始浓度为0.0216 mol·L-1。

则下列说法不正确的是
A. 30℃、pH=4.0 条件下,O3 的分解速率为 1.00×l0-4mol·L-1·min-1
B. pH增大能加速O3分解
C. 30℃、pH=7.0条件下分解速率小于40℃、pH=3.0
D. 10℃、pH=4.0条件下O3的浓度减少一半所需的时间(t)大于231min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有下列离子的各组溶液中分别通入一定量相应气体,各离子还能大量存在的是( )
A. Cu2+、SO42-,通硫化氢 B. Na+、S2O32-,通氯化氢
C. Ba2+、C1-,通二氧化硫 D. Ba2+、NO3-,通二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1∶2的是( )
A. 3S+6NaOH===2Na2S+Na2SO3+3H2O
B. 2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C. 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. I2+2NaClO3===2NaIO3+Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是重要的催化剂,可用某钒矿石(含有 V2O3、Fe、Al2O3等)来制备,工艺流程如下:

请回答下列问题:
(1) 钒矿石“粉碎”的目的为__________。
(2)“滤渣1” 中除 Al2O3、 Fe(VO3)2、 Fe(VO3)3外,还含有__________(填化学式)。
(3)“酸浸”时,若用硝酸代替双氧水和盐酸,弊端为__________。
(4)“滤渣 2” 的主要成分为 MgCO3、Fe(OH)3和 Al(OH)3,其中生成 Al(OH)3的离子方程式为__________。
(5) 若“净化Ⅰ” 时直接加入足量的(NH4)2CO3,可能导致的后果为__________。
(6)“煅烧”时,还生成参与大气循环的气体,该反应的化学方程式为__________。
(7)产品中 V2O5纯度的测定: 称取产品 a g, 先用硫酸溶解,得到(VO2)2SO4溶液;再加入 V1 mL c1 mol·L-1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O); 最后用 c2 mol·L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗 KMnO4标准溶液的平均体积为 V2 mL。假设杂质不参与反应,则产品中 V2O5的质量分数为__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu2O能与稀硝酸反应:Cu2O+HNO3→Cu(NO3)2+NO↑+H2O(未配平),若生成的NO标况下的体积为0.448L,下列说法正确的是( )
A. 被氧化的Cu2O是144g B. 作氧化剂的HNO3是0.14mol
C. 至少需要0.5mo/L的硝酸140mL与Cu2O反应 D. 转移的电子总数为0.06NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 向沸腾的蒸馏水中滴加饱和FeCl3溶液至溶液变红褐色:Fe3++3H2O=Fe(OH)↓+3H+ | 正确 |
B | 大理石溶于醋酸的反应: CaCO3+2H+=Ca2++CO2↑+H2O | 错误:CH3COOH写化学式,CaCO3写离子式 |
C | 铁与稀盐酸反应: Fe2++6H+=2Fe3++3H2↑ | 错误:产物不符合客观事实 |
D | NaOH与少量的CO2反应:OH-+CO2=HCO3- | 正确 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若w1=2w2,则c1<2c2,V=50 mL
B. 若w1=2w2,则c1>2c2,V<50 mL
C. 若c1=2c2,则w1<2w2,V<50 mL
D. 若c1=2c2,则w1<2w2,V>50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com