


科目:高中化学 来源:不详 题型:单选题
| A.提纯NaCl和KNO3的混合物中的KNO3:加热蒸发、冷却结晶,过滤 |
| B.除去CO2中混有的少量CO:混合气体依次通过NaOH溶液和浓硫酸 |
| C.除去盐酸中混有的少量CaCl2:加入过量CaCO3粉末,过滤 |
| D.除去NaCl溶液中混有的少量I2:向混合溶液中加入适量CCl4,充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液 |
| B.CaCO3粉末(CaCl2):过量盐酸 |
| C.Cu粉(Zn粉):过量盐酸 |
| D.CO2(O2):灼热的铜网 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过焰色反应观察到火焰为黄色,则试样一定含有钠离子,一定不含钾离子 |
B.加入有白色沉淀产生,再加盐酸,沉淀不消失,试样一定有SO |
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,试样一定有NH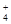 |
| D.加入硝酸银溶液产生白色沉淀,再加盐酸白色沉淀不消失,试样一定有Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.NaOH | C.Ba(OH)2 | D.AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸 | B.氢氧化钠溶液 | C.氯化钡溶液 | D.硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 滴入稀HNO3同时用pH试纸测定至溶液呈中性 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉充分反应并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | BaSO4 | BaCO3 | 加盐酸溶解、过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
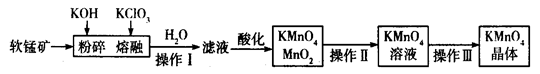
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com