
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
分析 A.氧气不能燃烧,为助燃物质;
B.CO2与H2O反应生成CH4和O2,为吸热反应;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性;
D.将固态碳合成C60,以C60作燃料,产物相同.
解答 解:A.氧气不能燃烧,为助燃物质,但可研究在水分解的情况下使氢成为二次能源,故A错误;
B.甲烷与氧气的反应为放热反应,可知CO2与H2O反应生成CH4和O2为吸热反应,故B错误;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性,利用优质催化剂、太阳能实现转化,故C正确;
D.将固态碳合成C60,以C60作燃料,产物相同,研究方向不可行,故D错误;
故选C.
点评 本题考查反应热与能源,为高频考点,把握物质的性质、反应中的能量变化、化学研究等为解答的关键,侧重分析与应用能力的考查,注意化学研究方案的可行性分析,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:推断题
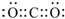 .
.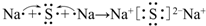 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
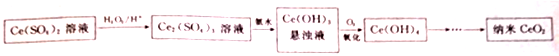
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
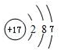 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.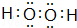 .
.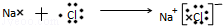 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业炼铁:需要用到的原料有铁矿石、焦炭、空气和生石灰 | |
| C. | 冶炼镁:将六水合氯化镁晶体在一定条件下加热得到无水氯化镁,电解熔融氯化镁,可以得到金属镁 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
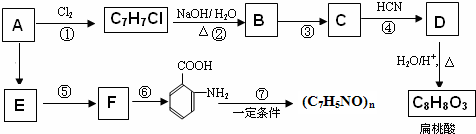
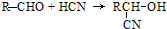
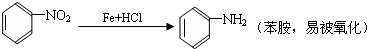
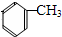 ;扁桃酸
;扁桃酸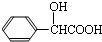 .
. .
. .
.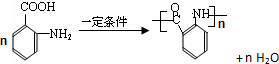 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com