
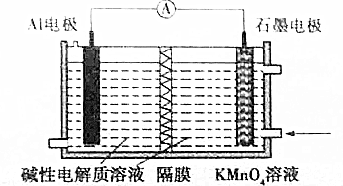
| A. | 溶液中OH-向石墨极移动 | |
| B. | A1电极附近溶液的pH保持不变 | |
| C. | 石墨极的电极反应式为MnO4-+3e-+4H═MnO2+2H2O | |
| D. | KMnO4中锰元素价态高,因此在同条件下放电容量比MnO2的大 |
分析 根据电极反应式为A1+Mn04-═AlO2-+MnO2知,铝电极作负极,失去电子发生氧化反应,石墨棒作正极,高锰酸根离子得电子生成氧化锰,电极反应式为MnO4-+3e-+2H2O═MnO2+4OH-,阴离子向负极移动,据此分析回答.
解答 解:根据电极反应式为A1+Mn04-═AlO2-+MnO2知,铝电极作负极,失去电子发生氧化反应,石墨棒作正极,高锰酸根离子得电子生成氧化锰,
A.铝电极为负极,阴离子向负极移动,OH-向铝电极移动,故A错误;
B.铝电极区为碱性电解质溶液,氢氧根离子参加反应,故pH减小,故B错误;
C.石墨棒作正极,电极反应式为MnO4-+3e-+2H2O═MnO2+4OH-,故C错误;
D.KMnO4中锰元素价态高,在发生反应过程中转移的电子数多,故在同条件下放电容量比MnO2的大,故D正确.
故选D.
点评 本题考查化学电源新型电池,为高考高频点,正确书写电极反应式是解本题关键,也是难点,要结合电解质溶液酸碱性书写,知道电解质溶液中阴阳离子移动方向,题目难度不大.


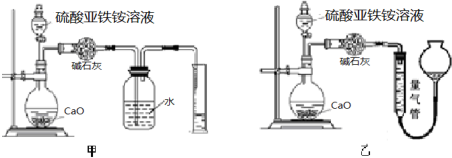
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Uuo的原子序数为118 | B. | ${\;}_{118}^{297}Uuo$的核内中子数为179 | ||
| C. | ${\;}_{118}^{297}Uuo$的核外电子数为118 | D. | Uuo的相对原子质量为297 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验式一定相同 | B. | 一定是同系物,有相同的通式 | ||
| C. | 只能是同种物质 | D. | 一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

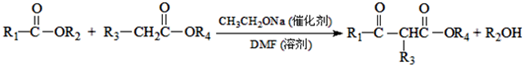
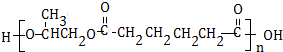 .
.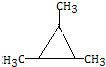 .
.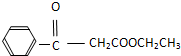
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有X、Y、W三种元素组成的化合物中既有离子键又有非极性共价键 | |
| B. | 简单离子半径由大到小的顺序是:Z>W>Y>X | |
| C. | 简单氢化物的沸点:W>Z,还原性:W>Z | |
| D. | Y、Z、W三元素形成的两种常见化合物的溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦⑧ | B. | ①②③④⑦ | C. | ①④⑥⑦ | D. | ①④⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com