
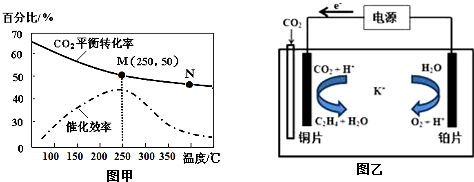
分析 (1)CO(g)+2H2(g)?CH3OH(g)
开始量(mol):1.2 1 0
转化量(mol):0.4 0.8 0.4
平衡量(mol):0.8 0.2 0.4
①结合c=$\frac{n}{V}$计算;
②结合v=$\frac{△c}{△t}$计算;
③由于反应是体积减小的反应,因此可以通过增大压强的方法提高CH3OH的生成速率,而且能使产物的产率增大;
(2)①4.4gCO2与H2完全转化为CH2═CH2和水(气态)共放出6.39kJ的热量,也即0.01mol的CO2与H2完全反应放出6.39kJ的热量,故2molCO2与H2完全反应放出的热量为:6.39kJ×20=127.8kJ,由此书写热化学方程式;
②a.温度越高,反应速率越大;
b.温度在约250℃时,催化剂的催化效率对应转化率最大;
c.转化率越大,乙烯的产量越大;
③图中M点时,转化率为50%,在密闭容器中充入体积比为 3:1的 H2和CO2,
对于反应6H2(g)+2CO2(g)=CH2=CH2(g)+4H2O(g)
起始量:3 1 0 0
转化量:1.5 0.5 0.25 1
剩余量:1.5 0.5 0.25 1
产物CH2═CH2的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%,进行计算;
(3)在电解池中,电源正极连接电解池阴极,在阴极处得电子,发生还原反应,发生的反应为二氧化碳与氢离子反应生成乙烯和水.
解答 解:(1)CO(g)+2H2(g)?CH3OH(g)
开始量(mol):1.2 1 0
转化量(mol):0.4 0.8 0.4
平衡量(mol):0.8 0.2 0.4
①达到平衡时CO的浓度为$\frac{0.8mol}{2L}$=0.4mol/L
故答案为:0.4mol/L;
②10min内用H2的浓度变化量△c(H2)=$\frac{0.8mol}{2L}$=0.4mol/L,
10min内用H2表示的平均反应速率v=$\frac{△c(H2)}{△t}$=0.04mol/(L.min)
故答案为:0.04mol/(L.min);
③由于反应是体积减小的反应,因此可以通过增大压强的方法提高CH3OH的生成速率,而且能使产物的产率增大.
故答案为:增大压强;
(2)①4.4gCO2与H2完全转化为CH2═CH2和水(气态)共放出6.39kJ的热量,也即0.01mol的CO2与H2完全反应放出6.39kJ的热量,故2molCO2与H2完全反应放出的热量为:6.39kJ×20=127.8kJ,热化学方程式为6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol,
故答案为:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol;
②a、温度越高,反应速率越快,N点的温度不是最高的温度,故a不正确;
b、读图可知,温度在约250℃时,催化剂的催化效率最高,故b正确;
c、读图可知,M点比N的CO2的转化率高,乙烯的产量也高,故c正确;
故选:a.
③对于反应6H2(g)+2CO2(g)=CH2=CH2(g)+4H2O(g)
起始量:3 1 0 0
转化量:1.5 0.5 0.25 1
剩余量:1.5 0.5 0.25 1
所以产物CH2═CH2的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%≈7.7%
故答案为:7.7% 或0.077;
(3)分析可知,电源的正极连接电解池的阴极,所以铜片为阴极,发生的反应为二氧化碳与氢离子反应生成乙烯和水,方程式为2CO2+12H++12e-═CH2=CH2+4H2O,
故答案为:2CO2+12H++12e-═CH2=CH2+4H2O.
点评 本题考查化学平衡的计算,为高频考点,把握图中温度与平衡的影响、平衡移动、平衡计算为解答的关键,侧重分析与应用能力的考查,注意化学平衡三段法的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:实验题
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝 ,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁
,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁 和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)

(1)操作a的名称为 ,所需要的玻璃仪器为 。
(2)固体E的成分为 ,加入的试剂④为稀硫酸,发生的化学方程式为 。
(3)加入试剂①的目的是 。
(4)从溶液D和溶液G中得到FeSO4•7H2O晶体的操作为 、冷却结晶、过滤、 、干燥。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )
H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )

查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为( )
A. 0.2mol/(L·s) B. 0.3mol/(L·s) C. 0.1mol/(L·s) D. 0.4mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(N2)=0.7 mol•L-1•min-1 | ||
| C. | v(NH3)=0.2mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
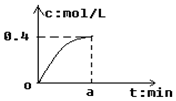 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2MnO2+2NH4++2e-═2MnO(OH)+2NH3 | B. | Zn-2e-═Zn2+ | ||
| C. | [Zn(NH3)2]2++2e-═Zn+2NH3 | D. | Mn4++e-═Mn3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com