
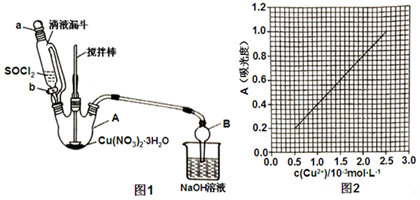
分析 含铁的铜屑用过量的硝酸溶解,得到的溶液为Cu(NO3)2、Fe(NO3)3的酸性溶液,条件pH沉淀铁离子,得到Cu(NO3)2溶液,蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Cu(NO3)2•3H2O晶体,与SOCl2制混合得到用无水Cu(NO3)2;
(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,据此分析;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)2•3H2O变质,出现晶膜后减慢结晶速度可得到较大颗粒的晶体;
(3)Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体;
(4)A、B间缺少干燥装置;向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
(5)由图可知,溶液吸光度A=0.600时,Cu2+标准溶液浓度为1.5×10-3mol/L,据此计算.
解答 解:(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,可选用CuO或Cu(OH)2或Cu2(OH)2CO3;
故答案为:CuO或Cu(OH)2或Cu2(OH)2CO3;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)2•3H2O变质,故蒸发浓缩应将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜减慢冷却结晶的速度,可得到较大颗粒的Cu(NO3)2•3H2O晶体;
故答案为:将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜;形成一层晶膜减慢冷却结晶的速度;
(3)第④步中发生的反应为Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体,化学方程式为:Cu(NO3)2•3H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCI↑;
故答案为:Cu(NO3)2•3H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCI↑;
(4)为防止B中的水蒸气进入A中,故在AB之间增加干燥装置;向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
故答案为:在AB之间增加干燥装置,防止B中的水蒸气进入A中;b;
(5)由图可知,溶液吸光度A=0.620时,Cu2+标准溶液浓度为1.6×10-3mol/L,则样品中Cu(NO3)2的质量为1.6×10-3mol/L×$\frac{100mL}{10mL}$×188g/mol=0.3008g,则无水Cu(NO3)2产品的纯度是$\frac{0.3008g}{0.3150}$×100%=95.5%;
故答案为:95.5%.
点评 本题考查了物质的制备,涉及了元素的相关性质,实验设计,操作控制,方程式的书写、纯度的计算等,要求学生对物质基本性质的掌握,并加以灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
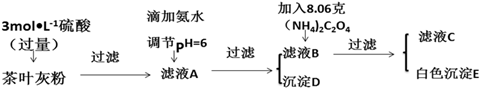
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com