
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 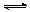 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。

(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。(已知lg2=0.3)
【知识点】常见金属元素的单质及其化合物的综合应用、制备实验方案的设计
【答案解析】 (1)漏斗、玻璃棒、烧杯(2分) Fe2O3、MgO(2分)
⑵Al(OH)3(2分) ⑶Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O(2分)
⑷K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。(2分)
⑸ ① 6,1,2H+,17,6,2,6 (6Fe+Cr2O72-+2H++17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑);(2分) ②5.6(2分)
解析:(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+
操作Ⅰ是过滤,得到不溶于水的固体X为Fe2O3、MgO;(2)用醋酸调节溶液pH=7~8后,将偏铝酸根沉淀成氢氧化铝,再进行操作Ⅱ过滤所得固体Y为:Al(OH)3(3)Cr2O72-具有强氧化性,会将氧化成Cl2,方程式为:Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);(5)①根据化合价升降进行配平:6Fe+Cr2O72-+2H++17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;②若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=0.052×10-3÷52=1×10-6mol/L,要使溶液中c(Cr3+)降到符合地表水限值,已知Cr(OH)3的Ksp=6.4×10-32=c(Cr3+)×c3(OH-),须调节溶液的c(OH-)≥4×10-9mol/L
PH≥5.6;
【思路点拨】本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等。


科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: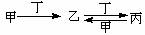 。下列有关物质的推断不正确的是( )
。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是
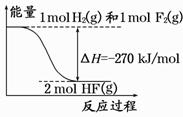
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键放出的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,
反应的化学方程式如下:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
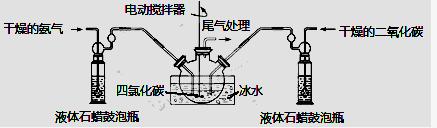
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
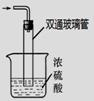
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水 充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]【来.源:全,】
查看答案和解析>>
科目:高中化学 来源: 题型:
进行下列实验操作时,一般情况下不应该相互接触的是
A.用移液管移取10 mL NaOH溶液并放于锥形瓶中,移液管的尖嘴和锥形瓶的内壁
B.减压过滤时,布氏漏斗下端管口与吸滤瓶的内壁
C.实验室将HCl气体溶于水时,倒扣的三角漏斗口与烧杯内的水面
D.分液操作分出下层液体时,分液漏斗下端管口和烧杯的内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。
下列说法错误的是( )
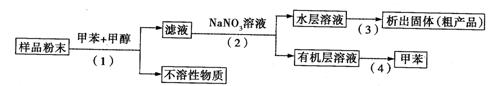
A.步骤(1)需要过滤装置 B.步骤(3)需要用到蒸发皿
C.步骤(4)是利用物质的沸点差异进行分离的
D.活性物质易溶于有机溶剂,难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法不可行的是
A.用水鉴别乙醇、甲苯和溴苯
B.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用燃烧法鉴别乙醇、苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,
反应的化学方程式如下:
2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 、 。

(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水 充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]【来.源:全,
查看答案和解析>>
科目:高中化学 来源: 题型:
下图标出了各种材料强度与密度的比值以及广泛使用的年代。

有甲、乙两种材料,它们的强度相同,甲的密度是乙的2倍。且甲材料在图中与b点对应,则乙材料在图中的位置是( )
A.a点 B.a、b之间
C.c点 D.b、c之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com