
【题目】如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )

A. 浓H2SO4B. NaCl溶液C. Ba(OH)2溶液D. NaOH溶液
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如图。请回答有关问题:
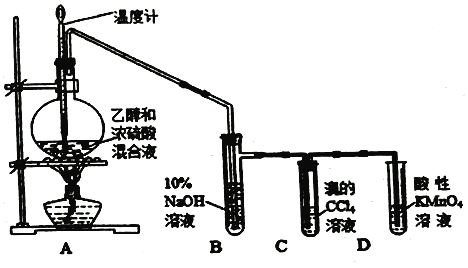
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是___________。
(2)烧瓶中产生乙烯的反应方程式为____________。
(3)反应开始后,可观察到C和D中共同的现象是___________;C中的反应类型为________、D中的反应类型为____________反应。
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是___________。
(5)10%的NaOH溶液起的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
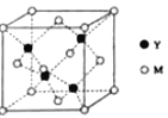
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。
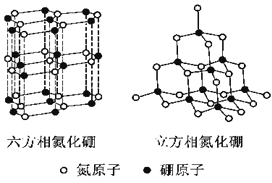
(1)基态硼原子的电子排布式为 。
(2) 关于这两种晶体的说法,正确的是 (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ,其结构与石墨相似却不导电,原因是 。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为 。该晶体的天然矿物在青藏高原在下约300km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有 mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A. 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. SiO2是良好的半导体材料,常用于制造计算机的芯片
C. Fe2O3俗称铁红,常用作红色的油漆和涂料
D. Cl2可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(H2)=0.6molL﹣1min﹣1,v(NH3)=0.4molL﹣1min﹣1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变。
A. ②③④ B. ①②④ C. ①③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l) △H。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。下列说法正确的是( )
AsO43-(aq)+2I-(aq)+H2O(l) △H。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。下列说法正确的是( )

A. t1时v逆小于t2时v逆
B. 该反应达到平衡时,2v生成(I-)=v生成(AsO33-)
C. 升高温度,c(AsO33-) 浓度增大,则△H>0
D. 增大c(OH-),平衡向正反应方向移动,平衡常数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(![]() )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是____________(填分子式)。产生这种结果的主要原因是____________________________________________
(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂_________,作用是_____________________。
②装置D加入的试剂_________,装置F加入的试剂_____________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是______________________________________。
④U型管G的作用为_______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com