
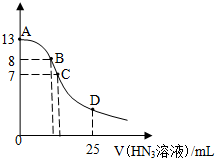
 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
分析 A.A点为氢氧化钠溶液,B点为氢氧化钠和NaN3的混合液,氢氧化钠浓度越小,水的电离程度越大;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,氢离子、氢氧根离子浓度较小,则c(Na+)>c(N3-)>c(OH-)>c(H+);
C.当加入12.5mLHN3(叠氮酸)溶液时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性;
D.根据D点V(HN3)=25 mL,所以得到等物质量浓度的NaN3和HN3,以HN3的电离为主溶液呈酸性.
解答 解:A.A点为氢氧化钠溶液,氢氧化钠浓度越大,水的电离程度越小,B点为氢氧化钠和NaN3的混合液,N3-水解促进了水的电离,则水电离出的c(H+):A点小于B点,故A正确;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,混合液中的氢离子、氢氧根离子浓度较小,则正确的离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B错误;
C.滴加的V(HN3)=12.5 mL时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性,而C点溶液的pH=7,所以C点V(HN3)>12.5 mL,故C错误;
D.根据D点V(HN3)=25 mL,所以得到等物质量浓度的NaN3和HN3,以HN3的电离为主溶液呈酸性,而N3-对叠氮酸的电离起抑制作用,所以c(H+)≈$\sqrt{1{0}^{-4.7}}$,故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH计算、离子浓度大小比较,题目难度中等,明确图象曲线对应溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se都含有34个中子 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| C. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se因含有相同的质子数故互为同位素 | |
| D. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se含有相同的电子数,因此性质一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水润湿的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,当有较多晶体析出时,停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
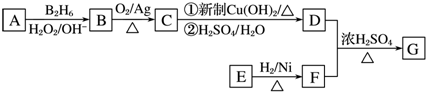
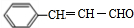 ;
;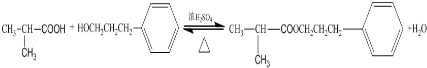 ;
;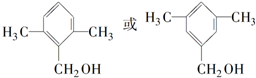 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol•L-1甲酸溶液的pH值约为2 | |
| B. | 甲酸电离出的阳离子全部是H+ | |
| C. | 10mL1 mol•L-1甲酸与10 mL1 mol•L-1NaOH溶液完全反应后,溶液呈碱性 | |
| D. | 1LH+浓度为0.1 mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有三个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com