
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:分析 W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的吸引电子的能力在同周期主族元素中最大,原子序数大于Si,故Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的吸引电子的能力在同周期主族元素中最大,原子序数大于Si,故Z为Cl元素,
(1)X为Na,原子核外电子数为11,有3个电子层,最外层电子数为1,处于周期表中第三周期IA族,故答案为:第三周期IA族;
(2)Z为Cl元素,非金属性Cl>Br,故氢化物稳定性HCl>HBr,故答案为:HCl;
(3)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大(或根据图象中原子半径排序),故原子半径:Na>Si>O,故答案为:Na>Si>O;
(4)X的一种氧化物与W的氢化物反应能够生成W的单质,应是过氧化钠与水反应生成氢氧化钠与氧气,该氧化物为Na2O2,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查位置结构性质关系应用,难度不大,推断元素是解题的关键,注意对元素周期律的理解与运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X>R | |
| C. | Z的单质能与Y的某些化合物发生置换反应 | |
| D. | R的最高价氧化物对应水化物分子为HRO3或H3RO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 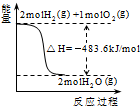 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 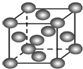 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 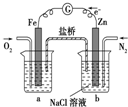 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com