
 用树状分类法对HCl、CO2、NaOH、Na2SO4、CaCO3、Ca(OH)2、H2SO4进行分类:
用树状分类法对HCl、CO2、NaOH、Na2SO4、CaCO3、Ca(OH)2、H2SO4进行分类:

科目:高中化学 来源: 题型:
A、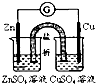 图中所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性(检流计的偏转方向为电子流的流动方向) |
B、 图中所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
C、 图中所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
D、 图中所示的实验:根据两试管中溶液颜色的变化(热水中变蓝、冰水中变粉)判断Co(H2O)62+(蓝色)+4Cl-?CoCl42-(粉红色)+6H2O是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
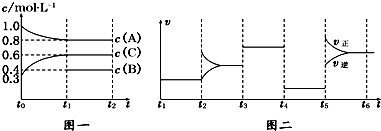
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 △H=
△H=| 试验编号 | 乙苯/mol | CO2/mol | He/mol | 温度/℃ |
| Ⅰ | 3.0 | 9.0 | 0 | 550 |
| Ⅱ | 3.0 | 9.0 | 0 | 600 |
| Ⅲ | 3.0 | 0 | a | 550 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池消耗的甲烷的物质的量至少有1 mol |
| B、阳极收到标况下的气体的体积为28L |
| C、阴极收到标况下的气体的体积为11.2L |
| D、若不考虑溶液体积变化,溶液的PH值为0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com