
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有铜离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,仅有B为紫色,只有B含有钾离子,所以E是氢氧化钠;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,D中产生白色沉淀,则D中含有硫酸根离子,所以D是硫酸铜;
⑤将B、C两溶液混合,未见沉淀或气体生成,则B是KCl,C为硫酸铝钾;
⑥A与E的溶液中具有相同的阳离子,所以A是碳酸氢钠,以此来解答.
解答 解:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有铜离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,仅有B为紫色,只有B含有钾离子,所以E是氢氧化钠;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,D中产生白色沉淀,则D中含有硫酸根离子,所以D是硫酸铜;
⑤将B、C两溶液混合,未见沉淀或气体生成,则B是KCl,C为硫酸铝钾;
⑥A与E的溶液中具有相同的阳离子,所以A是碳酸氢钠,
(1)由上述分析可知,B为KCl,D为CuSO4,故答案为:KCl;CuSO4;
(2)A受热分解的化学方程式为为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
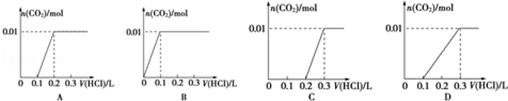
(3)NaHCO3+NaOH=Na2CO3+H2O,则反应后剩余0.01molNaOH,生成0.01molNa2CO3,再滴加盐酸,首先发生反应NaOH+HCl=NaCl+H2O、再HCl+Na2CO3=NaHCO3+NaCl,不放出气体,共消耗盐酸$\frac{0.02mol}{0.1L}$=0.2L,继续滴加盐酸时,发生NaHCO3+HCl=NaCl+H2O+CO2↑,生成0.01mol气体,此时又消耗盐酸为$\frac{0.01mol}{0.1mol/L}$=0.1L,共消耗盐酸0.3L,只有图象C符合,故答案为:C;
(4)NaOH过量,滴加过量E溶液,反应的离子方程式表示为Al3++4OH-=AlO2-+H2O,在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,铝离子为0.1mol,NaOH为0.175L×2=0.35mol,由Al3++3OH-═Al(OH)3↓可知生成0.1mol沉淀,消耗NaOH为0.3mol,然后发生Al(OH)3+OH-═AlO2-+2H2O,过量的0.05molMaOH溶解0.05mol沉淀,则生成沉淀的物质的量是0.05mol,故答案为:0.05.
点评 本题考查无机物的推断,为高频考点,把握离子的检验、离子的反应推断物质为解答的关键,涉及化学反应计算等,侧重分析、推断、计算能力的综合考查,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ba2+ | Ag+ | Na+ | Cu2+ |
| 阴离子 | NO3- | SO42- | OH- | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热水溶解纯碱能够提高去油污的效果 | |
| B. | 配制氯化铁溶液时滴加几滴稀盐酸可以防止氢氧化铁形成 | |
| C. | 硫酸铵和草木灰混合施用到农田可以增强肥效 | |
| D. | 盐碱地(含NaCl、Na2CO3)施加适量石膏可以降低土壤的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X可用作木材防火剂 | |
| B. | 步骤II的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+Na2SO4 | |
| C. | 步骤Ⅱ中的稀硫酸可用CO2来代替 | |
| D. | 步骤Ⅲ若在实验室完成,一般在蒸发皿中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 二氧化碳通过Na2O2粉末,反应后固体物质减轻 | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com