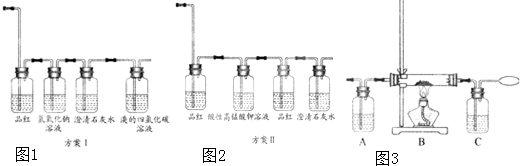
�����������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�ã�

��1��д���������������ƣ�a��
��b��
��c��
��2������a��e�У�ʹ��ǰ�������Ƿ�©ˮ����
������ţ�
��3������װ��I����ˮ�;ƾ��Ļ�����ȱ�ٵ�������
���������������������ʵ�飬�¶ȼ�ˮ�����λ����
��������ˮ��
��ͨ�룬
����������f��g��
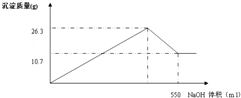
��4����������0.1mol/LNaOH��Һ450mL��װ�â���ijͬѧת����Һ��ʾ��ͼ��
��ͼ�еĴ�����
�ڳ���ͼ�и�����������������ƽ�⣬Ϊ���ʵ�黹��Ҫ�������У�
�۸��ݼ����֪������NaOH������Ϊ
g
������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��һ��������NaOH�������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ�����ܽ�
C���ָ������º�NaOH��Һ�ز�����ע��500mL������ƿ�У���������Һ�������������ƿ�⣩
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ������ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�2��3cm��
�ݰ����ϲ���������õ�NaOH��Һ�����ʵ���Ũ��
���ƫ�������䡱��ƫС����



 ��У����ϵ�д�
��У����ϵ�д�