
【题目】钢铁发生吸氧腐蚀时,正极发生的反应是( )
A.2H++2e﹣═H2↑
B.2H2O+O2+4e﹣═4OH﹣
C.Fe﹣3e═Fe3+
D.Fe﹣2e═Fe2+
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】工业用氧化铝与焦炭在氮气流中加强热制备氮化铝(AlN),氮化铝样品中含少量Al4C3、C、Al2O3杂质。某实验小组拟测定ag氮化铝样品中Al4C3含量并探究甲烷与氧化铜反应的氧化产物为CO2。
已知:(Ⅰ)AlN、Al4C3都能与水反应,分别生成NH3、CH4。
(Ⅱ)CH4还原氧化铜:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
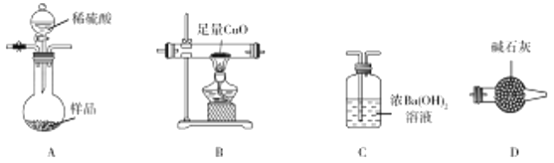
(1)装置连接顺序为 ________________________(按气流从左至右)。
(2)写出A中发生反应的化学方程式:AlN和稀硫酸反应:__________________________;Al4C3与
稀硫酸反应:_______________________________________________________________________。
(3)有下列操作步骤:
①缓缓向A中通入一定量的N2。
②称量B(酒精灯、木块和铁架台除外),按顺序组装仪器,检查装置的气密性,将样品放入烧瓶中;
③点燃B处酒精灯;
④再次称量B;
⑤从分液漏斗中缓慢滴入稀硫酸,直到不再产生气体为止;
⑥再次缓慢通入一定量的N2。
正确的操作顺序是_________________________;操作①的目的是_______________;若操作③与操作⑤顺序颠倒, 将导致测得的Al4C3的质量分数_________(填“偏大”“偏小”或“不变”)。
(4)设计实验证明A中有NH4+生成:__________________________________。
(5)实验结束后,测得B中固体质量减少bg,则样品中Al4C3的质量分数为________×100%。
(6)通过测定C中生成BaCO3的质量可以确定甲烷与氧化铜反应是否有CO生成。实验完毕后,测得B
中固体质量减少bg;对C中混合物进行过滤、洗涤、干燥、称重,当m(BaCO3)=________g时(用含b表达式表示),表明氧化产物只有CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
(3)写出有机物A可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将agNH3完全溶于水,得到VmLpH=8的氨水,假设该氨水密度为ρg·cm3,溶质的质量分数为ω,其中含NH4+的物质的量为bmol,下列叙述中一定正确的是
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为ω=![]() ×100%
×100%
C. c(OH-)=(![]() +10-8)mol·L-1
+10-8)mol·L-1
D. 为使溶液的质量分数等于0.5ω,应加入VmL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2 ![]() 2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2 , 同时生成2n mol NO2;
②单位时间内生成n mol O2 , 同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
A.①④⑤⑥
B.①②③⑤
C.②③④⑥
D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(2)a、b、c三点处,电离程度最大的是
(3)表是几种常见弱酸的电离平衡常数(25℃):
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOHCH3COO﹣+H | K=1.76×10﹣5 |
H2CO3 | H2CO3H++HCO3﹣H2CO3﹣H++HCO32﹣ | K1=4.31×10﹣7K2=5.61×10﹣11 |
HClO | HClOH++ClO﹣ | K=3.0×10﹣8 |
CH3COOH、H2CO3、HClO,其中酸性最强的是 , 最弱的是
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4
②NH3H2O . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两个热化学方程式中,△H1 和△H2的相对大小正确的是( ) S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2 .
A.△H1>△H2
B.△H1<△H2
C.△H1﹦△H2
D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com