
【题目】硼酸(![]() )为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1)![]() 中B元素的化合价为______。
中B元素的化合价为______。
(2)已知:![]() ,
,![]() 的电离方程式为____,酸性:
的电离方程式为____,酸性:![]() ___(填“>”或“<”)
___(填“>”或“<”)![]() 。
。
(3)![]() 受热分解得到
受热分解得到![]() ,
,![]() 和镁粉混合点燃可得单质B,写出生成单质B的化学方程式________,该反应中氧化剂和还原剂物质的量之比为______。
和镁粉混合点燃可得单质B,写出生成单质B的化学方程式________,该反应中氧化剂和还原剂物质的量之比为______。
(4)![]() 可用于生产储氢材料NaBH4。涉及的主要反应为:
可用于生产储氢材料NaBH4。涉及的主要反应为:
Ⅰ.![]()
Ⅱ.![]()
①“反应Ⅰ”的类型为______(填标号)。
a.取代反应 b.加成反应 c.加聚反应 d.氧化反应
②NaH的电子式为____________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和![]() ,其中H元素由
,其中H元素由![]() 价升高为
价升高为![]() 价,该反应的离子方程式为______。
价,该反应的离子方程式为______。
【答案】+3 H3BO3 + H2O![]() H+ + [B(OH)4]- > 3Mg+B2O3
H+ + [B(OH)4]- > 3Mg+B2O3![]() 2B + 3MgO 1:3 a
2B + 3MgO 1:3 a ![]() BH
BH![]() + 4Cu2+ + 8OH- =4Cu↓ + [B(OH)4]- + 4H2O
+ 4Cu2+ + 8OH- =4Cu↓ + [B(OH)4]- + 4H2O
【解析】
(1)根据H为+1价,O为-2价,结合化合价规则计算硼酸中硼元素化合价;
(2)B、Al同主族,H3BO3的电离与氢氧化铝的相似,结合非金属性越强,最高价氧化物对应水化物的酸性越强分析解答;
(3)B2O3和镁粉混合点燃可得单质B,还生成MgO,结合氧化还原反应的规律分析解答;
(4)①硼酸可以改写为B(OH)3,结合方程式中结构的变化分析判断;②NaH由钠离子与氢负离子构成的;③碱性条件下,BH![]() 与Cu2+反应生成Cu、[B(OH)4]-,其中H元素由-1价升高为+1价,结合氧化还原反应的规律书写离子方程式。
与Cu2+反应生成Cu、[B(OH)4]-,其中H元素由-1价升高为+1价,结合氧化还原反应的规律书写离子方程式。
(1)设H3BO3中B元素的化合价为x,则3×(+1)+x+3×(-2)=0,解得x=+3,故答案为:+3;
(2)由氢氧化铝的电离方程式可知,H3BO3的电离方程式为:H3BO3+H2O![]() H++[B(OH)4]-,非金属性B>Al,故酸性:H3BO3>Al(OH)3,故答案为:H3BO3+H2O
H++[B(OH)4]-,非金属性B>Al,故酸性:H3BO3>Al(OH)3,故答案为:H3BO3+H2O![]() H++[B(OH)4]-;>;
H++[B(OH)4]-;>;
(3)B2O3和镁粉混合点燃可得单质B,属于置换反应,还生成MgO,反应的化学方程式为:3Mg+B2O3![]() 2B+3MgO,反应中Mg元素的化合价升高,Mg被氧化,是还原剂,B2O3是氧化剂,反应中氧化剂和还原剂物质的量之比为1∶3,故答案为:3Mg+B2O3
2B+3MgO,反应中Mg元素的化合价升高,Mg被氧化,是还原剂,B2O3是氧化剂,反应中氧化剂和还原剂物质的量之比为1∶3,故答案为:3Mg+B2O3 ![]() 2B+3MgO;1∶3;
2B+3MgO;1∶3;
(4)①![]() 反应中硼酸中的3个-OH被3个OCH3替代,属于取代反应,故答案为:a;
反应中硼酸中的3个-OH被3个OCH3替代,属于取代反应,故答案为:a;
②NaH是由钠离子与氢负离子构成的,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
③碱性条件下,BH4-与Cu2+反应生成Cu、[B(OH)4]-,其中H元素由-1价升高为+1价,根据得失电子守恒,Cu与[B(OH)4]-的物质的量之比为4∶1,结合电荷守恒、原子守恒,可知反应的离子方程式为:3BH![]() +4Cu2++8OH-=4Cu↓+[B(OH)4]-+4H2O,故答案为:3BH
+4Cu2++8OH-=4Cu↓+[B(OH)4]-+4H2O,故答案为:3BH![]() +4Cu2++8OH-=4Cu↓+[B(OH)4]-+4H2O。
+4Cu2++8OH-=4Cu↓+[B(OH)4]-+4H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.由水电离出的c(H+)=10-13molL-1的溶液:K+、Ba2+、Cl-、CO32-
B.使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+
C.常温下![]() =1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
D.0.1molL-1盐酸的澄清透明溶液中:Fe3+、K+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5L的某密闭容器中发生如下反应:![]() ,经5min后,测得容器内B的浓度减少了
,经5min后,测得容器内B的浓度减少了![]() ,则下列叙述错误的是( )
,则下列叙述错误的是( )
A.在5 min内,该反应用C的浓度变化表示的反应速率为![]()
B.在5 min时,容器内D的浓度为![]()
C.该可逆反应未达限度前,随反应的进行,容器内压强逐渐增大
D.5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。科学家发现“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N原子排列成V形,如果5个N原子结合后都达到8电子结构,且含有2个氮氮叁键,则“N5”分子碎片所带电荷是_____,写出它的电子式________,1个“N5”正离子共有______个核外电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产![]() ,实验室可用如下装置
,实验室可用如下装置![]() 略去部分加持仪器
略去部分加持仪器![]() 模拟生成过程.
模拟生成过程.
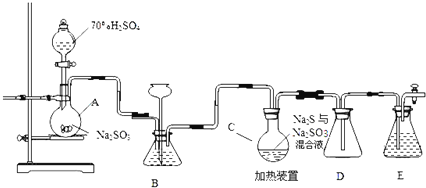
烧瓶C中发生反应如下:
![]()
![]() Ⅰ
Ⅰ![]()
![]()
![]() Ⅱ
Ⅱ![]()
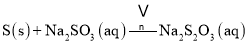
![]() Ⅲ
Ⅲ![]()
(1)装置A中发生的化学反应方程式为 ______
(2)为提高产品纯度,应使烧瓶C中![]() 和
和![]() 恰好完全反应,则烧瓶C中
恰好完全反应,则烧瓶C中![]() 和
和![]() 物质的量之比为 ______ .
物质的量之比为 ______ .
(3)装置B的作用之一是观察![]() 的生成速率,其中的液体最好选择 ______
的生成速率,其中的液体最好选择 ______
a.蒸馏水b.饱和![]() 溶液 c.饱和
溶液 c.饱和![]() 溶液d.饱和
溶液d.饱和![]() 溶液
溶液
实验中,为使![]() 缓慢进入烧瓶C,采用的操作是 ______ .
缓慢进入烧瓶C,采用的操作是 ______ .
(4)已知反应![]() Ⅲ
Ⅲ![]() 相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出![]() ,其中可能含有
,其中可能含有![]() 、
、![]() 等杂质.利用所给试剂设计实验,检测产品中是否存在
等杂质.利用所给试剂设计实验,检测产品中是否存在![]() ,简要说明实验操作,现象和结论: ______ .
,简要说明实验操作,现象和结论: ______ .
已知:![]() 遇酸易分解:
遇酸易分解:![]() 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液.
溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com