
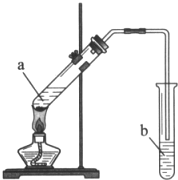
 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,饱和碳酸钠溶液的主要作用是溶解乙醇,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;导管不能插入液面下的原因是防止倒吸.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(2)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸,
故答案为:乙醇;浓硫酸;
(3)乙酸乙酯不溶于饱和碳酸钠溶液,乙醇易溶于水,乙酸可与碳酸钠发生反应而被吸收,用饱和碳酸钠溶液可将乙酸乙酯和乙醇、乙酸分离,反应的化学方程式为 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O;挥发出的乙酸、乙醇易溶于水,导气管下端管口不能浸入液面插入溶液中防止倒吸,导管要插在饱和碳酸钠溶液的液面上,伸入液面下会发生倒吸,
故答案为:饱和碳酸钠溶液;防止倒吸.
点评 本题考查乙酸已知的制备,题目难度中等,注意实验的原理以及实验操作注意事项和饱和碳酸钠的作用,题目难度不大.


科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列变化的实质相似的是( )
① 浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
② 二氧化硫和氯气均能使品红溶液褪色
③ 二氧化硫能使高锰酸钾溶液、溴水褪色
④ 氨气和碘化氢气体均不能用浓硫酸干燥
⑤ 常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥ 浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A.只有②③④ B.只有③⑤ C.只有③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
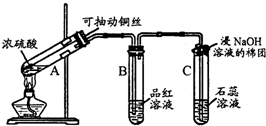
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
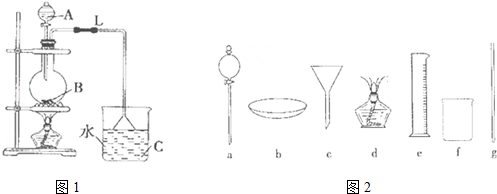
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
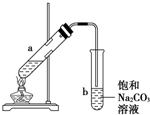 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
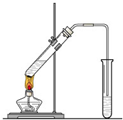 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
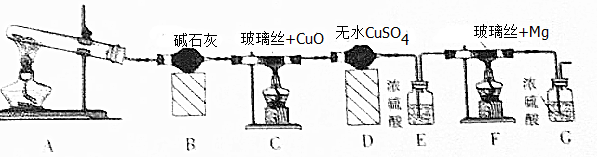
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A.Cl2 >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com