
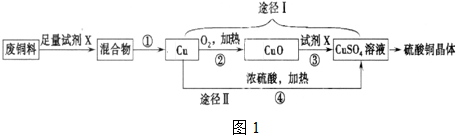
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;分析 制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,浓硫酸密度大于水,与蒸馏水混合时会放出大量热,所以混合时应该先加入蒸馏水,再加入浓硫酸,然后加入乙醇和溴化钠,小火加热,在烧瓶中发生反应,烧瓶中发生的反应有:溴化钠与硫酸反应生成硫酸氢钠和溴化氢、乙醇与溴化氢反应生成溴乙烷和水,b是安全瓶防止液体倒吸.锥形瓶的水中插有一直玻璃管,主要作用是检查试管c是否堵塞.当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,已知溴乙烷的沸点为38.4°C,冷水可以将溴乙烷蒸气变成液态溴乙烷,反应剩余的溴化氢、反应副产物溴等有毒,能够污染大气,需要进行尾气吸收,
(1)浓硫酸与蒸馏水混合过程中会放出大量热,浓硫酸密度大于水,应该先稀释浓硫酸、冷却后再加入乙醇、溴化钠;
(2)烧瓶中发生的反应有:溴化钠与硫酸反应生成硫酸氢钠和溴化氢、乙醇与溴化氢反应生成溴乙烷和水,据此写出反应的化学方程式;
(3)已知溴乙烷的沸点为38.4°C,冷水可以将溴乙烷蒸气变成液态溴乙烷;根据溴乙烷不溶于水、密度大于水进行分析;
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(5)当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(6)反应剩余的溴化氢、反应副产物溴等有毒,能够污染大气,需要进行尾气吸收;
(7)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等,据此进行解答.
解答 解:(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,浓硫酸密度大于水,与蒸馏水混合时会放出大量热,所以混合时应该先加入蒸馏水,再加入浓硫酸,然后加入乙醇和溴化钠,
故答案为:蒸馏水、浓硫酸、乙醇、溴化钠;
(2)根据加入的反应物可知,烧瓶中发生的反应为:①溴化钠与硫酸反应生成硫酸氢钠和溴化氢,反应的方程式为:NaBr+H2SO4=NaHSO4+HBr、②乙醇与溴化氢反应生成溴乙烷和水,反应的化学方程式为CH3CH2OH+HBr→CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr→CH3CH2Br+H2O;
(3)溴乙烷的沸点为38.4°C,通过冷水可以冷却溴乙烷,将溴乙烷由气态变成液态;由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,
故答案为:冷却溴乙烷由气态转变为液态;分层,下层为油状液体;
(4)A.NaI和溴单质反应,但生成的碘单质会混入,故A错误;
B.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故B错误;
C.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故C正确;
D.KCl和溴单质不反应,不能除去溴单质,故D错误;
故答案为:C;
(5)通过观察实验装置,可知b是安全瓶防止液体倒吸.锥形瓶的水中插有一直玻璃管,主要作用是检查试管c是否堵塞.当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,
故答案为:直导管中有一段水柱;
(6)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收HBr等气体,防止大气污染;
(7)A.乙醇在浓硫酸作用下反应发生消去反应生成烯烃、分子间脱水反应生成醚,稀释后减少了生成的副产物烯和醚,故A正确;
B.浓硫酸具有强氧化性,能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,故B正确;
C.反应需要溴化氢和乙醇反应,浓硫酸溶解会使温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故C正确;
D.水在制取溴乙烷的反应中为反应产物,不是该反应的催化剂,故D错误;
故答案为:ABC.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,明确物质的性质及实验原理是设计实验的前提,同时考查了学生分析问题、解决问题的能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
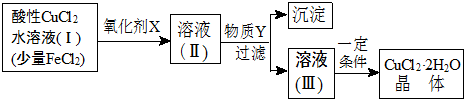
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
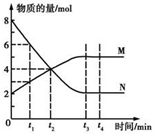
| A. | 反应的化学方程式为2 M?N | |
| B. | t2 min时,正逆反应速率相等,反应达到平衡 | |
| C. | t3 min后,正逆反应仍在进行 | |
| D. | t3~t4 min时,v正(N)=v逆(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
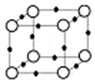 在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
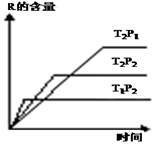 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com