
右图曲线a表示放热反应X(g)+Y(g) 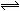 Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
 A 加催化剂
A 加催化剂
B加大X的投入量
C 升高温度
D增大体积
科目:高中化学 来源: 题型:
科学家研制出多种新型杀虫剂代替DDT,其中一种的结构如图。下列关于该有机物的说法正确的是 ( )
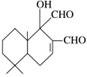
A.该有机物既能发生氧化反应,又能发生酯化反应
B.与FeCl3溶液发生反应后溶液显紫色
C.1 mol 该有机物最多可以与2 mol Cu(OH)2反应
D.1 mol 该有机物最多与1 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若将盐酸体积改为60 mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
① Cl 2 (g) + H2 (g)  2HCl (g) Δ H = -184.6 kJ/mol
2HCl (g) Δ H = -184.6 kJ/mol
② CaCO3 (s)  CaO (s) + CO2 (g) Δ H = +178.2 kJ/mol
CaO (s) + CO2 (g) Δ H = +178.2 kJ/mol
③ 2Na (s) + Cl 2 (g)  2NaCl (s) Δ H = -822.0 kJ/mol
2NaCl (s) Δ H = -822.0 kJ/mol
请回答:
(1)上述反应中属于放热反应的是 (填序号,下同),属于吸热反应的是 。
(2)生成1 mol NaCl(s)时,Δ H = ____ kJ/mol。
(3)1000 g CaCO3(s)完全分解时,吸收的热量为____ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n molSO2的同时消耗n molO2
E.相同时间内消耗2n molSO2的同时生成n molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达平衡,平街常数K=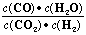 ,已知恒容时温度升高,H2浓度减小。下列说法正确的是
,已知恒容时温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值(△H﹥0)
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O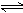 CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应A(气)+2B(气)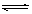 2C(气)△H<0的平衡体系,下列说法错误的是
2C(气)△H<0的平衡体系,下列说法错误的是
A.使用催化剂,v正、v逆都改变,变化的倍数相同
B.升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
C.增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数
D.降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com