
 用右图所示装置进行实验,将A逐滴加入B中;
用右图所示装置进行实验,将A逐滴加入B中;| 水溶 |
| △ |
| 水溶 |
| △ |
| 水溶 |
| △ |
| 水溶 |
| △ |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
 (4分).(1)温度计常用来监测或控制化学实验的温度。
(4分).(1)温度计常用来监测或控制化学实验的温度。
请说明下列实验中温度计的水银球所处的位置:实验室制乙烯____________________,用蒸馏法进行混合物的分离_______________________________。
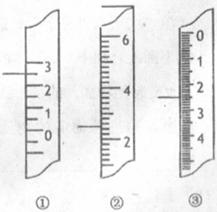
(2)右图分别是温度计、量筒、滴定管的一部分,
下述读数(左侧实线标注位置)及说法正确的是_______ 。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5 mL
 C.③是滴定管,读数为3.5 mL
C.③是滴定管,读数为3.5 mL
D.①是温度计,读数为2.
(3)某同学用右图所示装置,将气体发生装置中产生的氯化氢直接通入水中配制少量盐酸,结果发生了水的倒吸。在不增加仪器(可选择必需的试剂)的前提下将右图装置稍加改进,即可安全地在试管中用水吸收氯化氢,改进的方法是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
现代工业将煤炭气化后,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以制成许多清洁能源、扩大水煤气的广泛用途。
(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0kJ.mol-1;
②2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ.mol-1
则反应C(s)+ H2O(g)= CO(g) + H2(g);△H=____ 。
(2)工业上有一种用CO2 来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
 现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
①下列时间段平均反应速率最大的是______(填序号),
A.0~1min B.1~3min
C.3~8min D.8~11min
其速率是:υ(H2)=_________ 。
② 平衡时氢气的转化率 ;该条件下
反应的平衡常数K= 。
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是_____________。
(3)某研究所组装的CH3OH—O2燃料电池的
工作原理如图所示。

①该电池工作时,b口通入的物质为 ,
②该电池正极的电极反应式为: 。
 ③以此电池做电源,在实验室中模拟铝制品表面
③以此电池做电源,在实验室中模拟铝制品表面
“钝化”处理(装置右图所示)的过程中,发现溶液
逐渐变浑浊并有气泡产生,其原因可能是
(用相关的离子方程式表示):
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com