
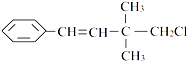 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
科目:高中化学 来源: 题型:
| A、IA族 | B、ⅡA族 |
| C、ⅢA族 | D、IVA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B、试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C、反应后试管中剩余的固体混合物的总质量为7.2 g |
| D、反应生成铜和氧化亚铜的总物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、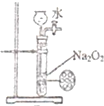 制备少量的氧气 |
B、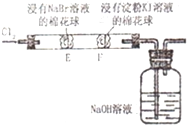 证明氧化性Cl2>Br2>I2 |
C、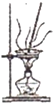 将海带灼烧成灰 |
D、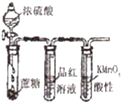 说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/LCH3COONa与0.1mol/LHCl溶液等体积混合(pH<7):c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-) |
| B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| D、0.1mol/LNa2CO3与0.2mol/L NaHCO3溶液等体积混合:3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
| B、将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度盐酸反应,前者速率大于后者 |
| C、两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
| D、相同条件下等质量的块状和粉末状大理石与相同浓度盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com