
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
分析 A、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol碳氧双键来分析;
B、求出硫酸氢钠的物质的量,然后根据硫酸氢钠由1个钠离子和1个硫酸氢根构成来分析;
C、标况下溴为液态;
D、求出过氧化钠的物质的量,然后根据1mol过氧化钠和水反应转移1mol电子来分析.
解答 解:A、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含2mol碳氧双键,故0.5mol二氧化碳中含1mol碳氧双键即NA个,故A错误;
B、12g硫酸氢钠的物质的量为0.1mol,而硫酸氢钠由1个钠离子和1个硫酸氢根构成,故0.1mol硫酸氢钠中含0.1mol阳离子即0.1NA个,故B正确;
C、标况下溴为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠和水反应转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ S2- CO32- | B. | AlO21 SO42- MnO4- | ||
| C. | NO3- Cl- SO42- | D. | MnO4- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
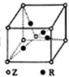 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
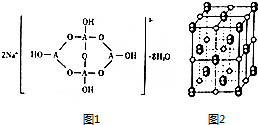 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题: .
.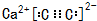 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
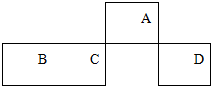 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )| A. | C元素在地壳中的含量仅次于氧元素 | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 元素A与元素B形成的化合物BA是一种新型无机非金属材料 | |
| D. | 实验室可用B的单质与A元素最高价氧化物对应的水化物反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
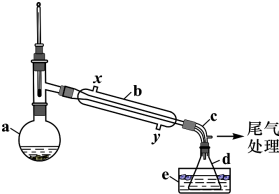
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③② | B. | ①④③② | C. | ①③④② | D. | ④②①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com