
分析 由制备流程可知,废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质),试剂①为NaOH,Fe、Mg不反应,只发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,过滤后,滤液含NaAlO2,与碳酸氢氨反应生成氢氧化铝沉淀,B为Al(OH)3,最后加硫酸、硫酸钾得到明矾,以此来解答.
解答 解:(1)Fe、Mg与强碱不反应,而Al与NaOH溶液反应,则为尽量少引入杂质,试剂①应选用NaOH,故答案为:D;
(2)易拉罐溶解过程中主要反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)由上述分析可知,沉淀B为Al(OH)3,将少量明矾溶于水,溶液呈弱酸性,其原因是Al3+水解,使溶液中H+浓度增大,故答案为:Al(OH)3;Al3+水解,使溶液中H+浓度增大.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程、物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A 原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的 原子序数为29.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A 原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的 原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
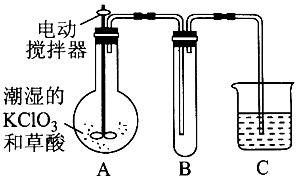
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 已知时25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| C. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c (Mg2+)=1.8×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的单质的熔点最高 | B. | B元素的非金属性最强 | ||
| C. | C的简单离子半径最小 | D. | D的原子半径最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com