
下列反应既属于非氧化还原反应,又是吸热反应的是( )
A.铝片和稀硫酸反应 B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的碳与二氧化碳反应 D.甲烷在氧气中燃烧
考点:吸热反应和放热反应;氧化还原反应.
分析:没有化合价变化的反应是非氧化还原反应.大多数的分解反应、焦炭和二氧化碳的反应、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热反应.
解答: 解:A、铝片和稀硫酸的反应是放热反应,铝化合价升高,氢化合价降低,是氧化还原反应,故A错误;
B、Ba(OH)2•8H2O与NH4Cl的反应属于吸热反应,没有化合价变化,是非氧化还原反应,故B正确;
C、灼热的炭与CO2的反应既属于氧化还原反应,又是吸热反应,故C错误.
D、甲烷在氧气中的燃烧属于放热反应,也是氧化还原反应,故D错误;
故选B.
点评:本题考查学生非氧化还原反应的概念和常见的吸热和放热反应判断,难度不大,注意抓住是否有化合价变化判断是否是氧化还原反应.


科目:高中化学 来源: 题型:
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同
Y元素的族序数是周期序数的三倍
Z元素的电负性在所有元素中最大
W原子的第一至第六电离能分别为:I1=578KJ•mol﹣1,I2=1817KJ•mol﹣1,I3=2745KJ•mol﹣1,I4=11575KJ•mol﹣1,I5=14830KJ•mol﹣1,I6=18376KJ•mol﹣1
Q为前四周期中电负性最小的元素
R原子最高能层上只有1个单电子,其余各能层均已充满电子.
请回答:
(1)R在周期表中位于 区,写出R基态原子的价电子排布式 .
(2)X与Y形成的二元化合物中属于非极性分子的 (用化学式表示).
(3)写出Z元素的单质与水反应的方式 ,此反应中氧化剂与氧化产物物质的量之比为 .
(4)X的氯化物的熔点比Q的氯化物的熔点 (“高”或“低”),理由是 .
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]﹣生成,则中[W(OH)4]﹣﹣存在 (填选项字母)
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石(4个碳原子在立方体体内,其余碳原子分别位于面心和顶角)相似,硬度与金刚石相当,则金刚砂的晶胞中含有 个硅原子, 个碳原子,其中硅原子的杂化方式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量
②升高温度
③缩小反应容器的体积
④加入生成物
⑤加入MnO2.
A.全部 B.①②⑤ C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理:
(2)炒菜时,经常加入少量的料酒(含乙醇)和醋(含乙酸),可使菜变得香醇可口,用化学方程式表示该反应的原理: .
(3)工业上在一定条件下电解熔融氯化钠制取金属钠,写出该反应的化学方程式:
(4)CH4与Cl2在光照条件下能生成CH3Cl,写出该反应的化学方程式:
(5)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应过程的能量变化如图所示,下列说法正确的是( )
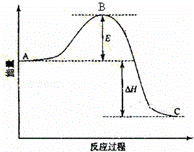
A.该反应过程为吸热反应
B.若加入催化剂,B点会降低
C.若加入催化剂,△H数值会减小
D.若升高温度,则平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量醋酸钠溶液 D.加入适量的硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)请写出该合金中铁与硝酸反应的离子方程式 .
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 .
(4)B与A的差值为 mol.
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
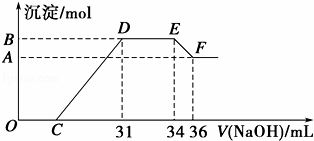
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com