考点:晶胞的计算,判断简单分子或离子的构型,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)在Na
2B
2O
7、CaF
2、H
3BO
3、NH
3四种物质中,Na
2B
2O
7、CaF
2、都是离子化合物,所形成的晶体是离子晶体,H
3BO
3、NH
3都属共价化合物是分子晶体;
(2)硼酸的电离方程式为H
3BO
3+H
2O?[B(OH)
4]
-+H
+,其原理是H
3BO
3结合了水电离出来的氢氧根离子,按这一原理可写出[Al(OH)
4]
-的结构式;
(3)根据NH
3和BF
3分子的结构可以分析得出分子的空间构型、N的杂化方式、孤电子对数及分子的极性;
(4)根据硼、氧、氟、氮在周期表的位置,利用元素周期律可以判断电负性和第一电离能;
(5)A、B晶体的熔点为1873℃,很高,所以是原子晶体,根据B晶体的结构图可以看出每个B原子周围有五个共价键,由两个B原子共用,分配到每个B原子占有2.5个共价键,该结构单元含有12个B,所以共价键的个数为30个;
B、该结构单元中每个B连有五个正三角形,而每个B能形成
个正三角形,所以该结构单元含有正三角形的个数为:12×5×
=20;
C、该结构中,只含B原子,同种原子之间只能形成非极性键,没有极性键;
D、硅晶体中每个硅原子周围有四个共价键,而硼晶体周围有五个共价键,所以它们的结构是不一样的;
(6)①、根据图2可知六方氮化硼晶体结构与石墨相似,层与层之间的作用力为分子间作用力;
②、B原子最外层有3个电子,可以形成3个共价键,而N最外层有5个电子,也可以形成3个共价键达到稳定结构,所以B与N个数比为1:1,根据图2结构可以看出,每个B或N都可以被三个六边形共用,所以每个六边形实际占有B或N的个数为3×
=1,每个B-N键被两个六边形共用,所以每个六边形实际占有B-N键为3个.
解答:
解:(1)在Na
2B
2O
7、CaF
2、H
3BO
3、NH
3四种物质中,Na
2B
2O
7、CaF
2、都是离子化合物,所形成的晶体是离子晶体,H
3BO
3、NH
3都属共价化合物是分子晶体,所以只有C选项正确,A、B、D选项都错误,故答案为:C;
(2)硼酸的电离方程式为H
3BO
3+H
2O?[B(OH)
4]
-+H
+,其原理是H
3BO
3结合了水电离出来的氢氧根离子,每个B原子周围连有四个氢氧根,按这一原理可写出[Al(OH)
4]
-的结构式为:
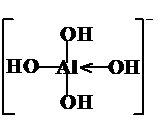
,故答案为:
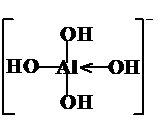
;
(3)在NH
3中N最外层有5个电子,与3个H原子形成3对共用电子对,另外还有一对孤电子对,所以N原子发生sp3杂化,分子的空间构型是三角锥形,是极性分子,故选项A错误,选项B正确;在BF
3中B最外层只有3个电子,可与3个F形成3个共用电子对,无孤电子对,B原子发生sp2杂化,分子空间构型为平面三角形,是非极性分子;故选项C正确,D选项错误,故答案为:BC;
(4)硼、氧、氟、氮都在周期表的第二周期,按硼、氮、氧、氟的顺序原子序数逐渐增大,元素的电负性也逐渐增大,即B<N<O<F,第一电离能也应逐渐增大,但由于氮原子位于ⅤA族,最外层电子处于半充满的稳定状态,所以第一电离能比氧大,所以第一电离能的大小顺序为:F>N>O>B,
故答案为:B<N<O<F;F>N>O>B;
(5)A、因为B晶体的熔点为1873℃,很高,所以是原子晶体,根据B晶体的结构图可以看出每个B原子周围有五个共价键,由两个B原子共用,分配到每个B原子占有2.5个共价键,该结构单元含有12个B,所以共价键的个数为30个,故A选项正确;
B、该结构单元中每个B连有五个正三角形,而每个B能形成
个正三角形,所以该结构单元含有正三角形的个数为:12×5×
=20,故B选项错误;
C、该结构中,只含B原子,同种原子之间只能形成非极性键,没有极性键,故C选项错误;
D、硅晶体中每个硅原子周围有四个共价键,而硼晶体周围有五个共价键,所以它们的结构是不一样的,故D选项错误;
故答案为:A
(6))①、根据图2可知六方氮化硼晶体结构与石墨相似,层与层之间的作用力为分子间作用力,故答案为:分子间作用力;
②、B原子最外层有3个电子,可以形成3个共价键,而N最外层有5个电子,也可以形成3个共价键达到稳定结构,所以B与N个数比为1:1,根据图2结构可以看出,每个B或N都可以被三个六边形共用,所以每个六边形实际占有B或N的个数为3×
=1,每个B-N键被两个六边形共用,所以每个六边形实际占有B-N键为3个,氮原子、硼原子和氮-硼键数目之比为:1:1:3,故答案为:1:1:3.
点评:本题考查了学生对分子空间构型、晶体的类型、元素周期律、晶胞的有关计算等知识的掌握情况,难度不大,但在答题时要注意审题,按要求答题.


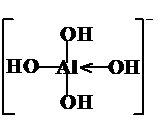 ,故答案为:
,故答案为: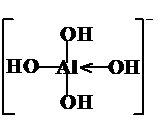 ;
;

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案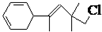 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )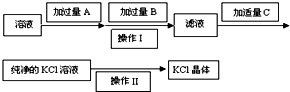 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作: