
(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、____________、____________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____________g。
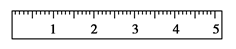
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了_____________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 | B.容量瓶用蒸馏水洗净后未干燥 |
C.定容时俯视读取刻度 | D.定容时液面超过了刻度线 |
E.称量NaCl时用了生锈的砝码
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是_________(填操作序号)。
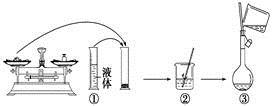
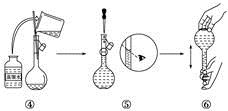
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
每次实验焰色反应后都要用试剂清洗铂丝,这种清洗试剂是
A.Na2CO3溶液 B.NaOH溶液 C.硫酸 D.盐酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度 B.升高温度同时充入N2
C.增大压强同时加催化剂 D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
在化学反应A(g)+3B(g)  2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.v(A)=v(B) B.v(A)=2v(C) C.3v(B)=v(C) D.v(B)=3v(D)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是
A. 分液漏斗 B. 普通漏斗 C. 蒸馏烧瓶 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com