
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是 ( )
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |
科目:高中化学 来源: 题型:阅读理解
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
| ||
| ||
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
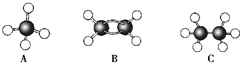
 可简写为
可简写为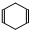 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: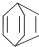 .
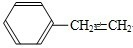
.


| 催化剂 |
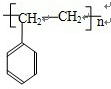

| 催化剂 |





查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.相对分子质量相同的物质是同一物质
B.具有相同通式的不同物质一定属于同系物
C.分子式相同而结构不同的有机物一定是同分异构体
D.各种有机物都由一定的元素组成,由一定元素组成的物质只能形成一种有机物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市十三校高三12月联考化学试卷(解析版) 题型:计算题
钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放人28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入粉末质量/g |
13.68 |
27.36 |
34.20 |
|
生成气体的体积(标准状况)/L |
2.912 |
5.824 |
6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是 (写化学式),样品中n(Fe)∶n(Fe3O4)= ,m= 。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com