
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
分析 NaHC2O4溶液显弱酸性,说明HC2O4-的电离程度大于其水解程度,
A.加入H2C2O4固体后,溶液中氢离子浓度增大,抑制了水的电离;
B.恰好反应后生成Na2C2O4,C2O42-部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42-的水解,则c(H+)>c(HC2O4-);
C.溶液为中性,则c(H+)>c(OH-),根据溶液中的电荷守恒判断;
D.根据混合液中的物料守恒分析.
解答 解:NaHC2O4溶液显弱酸性,说明HC2O4-的电离程度大于其水解程度,
A.酸溶液抑制了水的电离,加入H2C2O4固体后,溶液中氢离子浓度增大,则水的电离程度减小,抑制了水的电离,故A错误;
B.加入NaOH溶液至恰好完全反应生成Na2C2O4,C2O42-部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42-的水解,则c(H+)>c(HC2O4-),正确的离子浓度大小为:c(Na+)>c(C2O42-)>c(H+)>c(HC2O4-),故B错误;
C.中性溶液中c(H+)>c(OH-),根据电荷守恒可得:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-),故C正确;
D.加入0.01 mol Na2C2O4固体,混合液中含有等浓度的Na2C2O4和NaHC2O4,根据物料守恒可得:2c(Na+)=3[c(H2C2O4)+c(HC2O4- )+c(C2O42-)],故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 解释或结论 | |
| A | 向Na2CO3浓溶液中通入足量CO2溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| B | 常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH | 酸性:H2CO3<H2SO3 |
| C | 向2mL 1mol/LAlCl3溶液中加入几滴1mol/LNaOH溶液,生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色 | Ksp:Al(OH)3>Fe(OH)3 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇用于汽车防冻液 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物不同 | |
| D. | H2N-CH2-COOH的缩聚产物中含  结构 结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
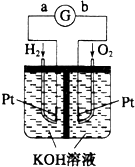 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
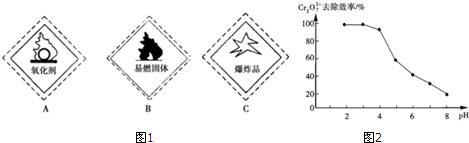
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
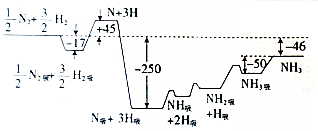 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com