
分析 (1)常温下,浓硫酸与铝发生钝化反应;
(2)MgO为离子晶体,熔点高;
(3)氯水中含有不稳定的HClO;
(4)NaAlO2溶液与弱酸反应生成Al(OH)3.
解答 解:(1)常温下,浓硫酸与铝发生钝化反应,在表面生成一层致密的氧化物膜,故答案为:钝化;
(2)MgO为离子晶体,熔点高,常用作耐火材料,故答案为:熔点;
(3)氯水中含有不稳定的HClO,在光照条件下可分解生成氧气,故答案为:O2(或氧气);
(4)NaAlO2溶液与弱酸反应生成Al(OH)3,可在溶液中通入二氧化碳气体,故答案为:CO2.
点评 本题综合考查元素化合物知识,涉及硫酸、氧化镁、氯水以及铝的化学物的性质的考查,有利于培养学生良好的科学素养,培养学生的双基,难度不大,注意相关基础知识的积累.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
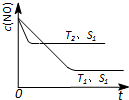 (1)已知在常温常压下:
(1)已知在常温常压下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硝酸洗涤做过银镜反应的试管 | |
| B. | 用电石和饱和食盐水在启普发生器中制备乙炔 | |
| C. | 用苯、稀硝酸和稀硫酸制备硝基苯 | |
| D. | 溴乙烷与氢氧化钠水溶液共煮后,加入硝酸银溶液检验Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +8 | C. | +7 | D. | +5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属氧化物灼烧时有特殊的颜色,因此可用于制造烟花 | |
| B. | 明矾可用作净水剂 | |
| C. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热法可以除去氯化铵中的少量碘单质 | |
| B. | 向试液中滴加双氧水可KSCN溶液,溶液变为红色,则试液中一定含Fe2+ | |
| C. | 向某固体中滴加稀硫酸,产生的气体能使澄清石灰水变浑浊,则该固体一定是苏打或小苏打 | |
| D. | 向含少量硫酸铁的硫酸铜溶液中加入过量的氧化铜,过滤,得到纯净硫酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com