
| A. | 特氟隆(聚四氟乙烯)的单体是氟利昂 | |
| B. | 蛋白质是由氨基酸形成的可水解的高分子化合物,其水溶液有丁达尔现象 | |
| C. | 聚丙烯的结构简式为: | |
| D. | 石英的化学式为CaSiO3 |
科目:高中化学 来源: 题型:选择题
| A. | 降低温度,溶液中c(NH4+)增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入水时,溶液中c(OH-)/c(NH3•H2O) 增大 | |
| D. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向Ba(NO3)2溶液中通入过量SO2:3Ba2++3SO2+2NO3-+2H2O═2NO↑+3BaSO4↓+4H+ | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/LNaHSO4与0.5mol/LBa(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2mol/LFe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20mL0.5mol/LFeBr2(aq)中通入224mLCl2(标况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30mL0.5mol/LNaOH(aq)中通入224mLCO2(标况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
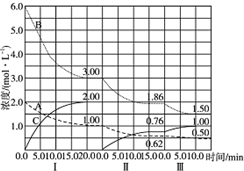 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑦ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com