
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
(4)在同一容器中加nmolA和3n molB,则平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m间变化,那么,n与m的关系是_____________。(用字母n、m关系式表示)
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:填空题
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②: 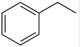 (g)→
(g)→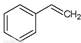 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是 。
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动; |
| C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大; |
| D.压缩体积,平衡不移动,反应物和产物的浓度都不变; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K= 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ;K值为 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a = c。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为CrO42-H+①转化Cr2O72-Fe2+②还原Cr3+OH-③沉淀Cr(OH)3↓。
其中第①步存在平衡2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要 mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为 。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的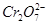 和
和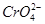 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为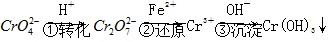 。
。
其中第①步存在平衡2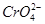 (黄色)+2H+
(黄色)+2H+
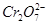 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 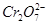 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含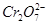 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。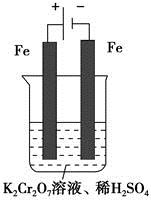
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成,回答下列问题:
mol,有a mol D生成,回答下列问题:
(1)反应2 min内v(A)=________,v(B)=________
(2)化学方程式中,x=__________,y=__________,p=________,q=________
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”、“减小”或“不变”),理由是________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
可逆反应A(?)+aB(g)  C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。试回答下列问题: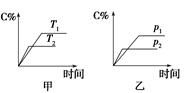
(1)化学方程式中a= ,反应物A的状态是 。
(2)该反应的焓变值ΔH (填“>”或“<”)0,在不改变其他条件的情况下增加B的物质的量,平衡 (填“正”或“逆”)向移动,平衡常数K (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):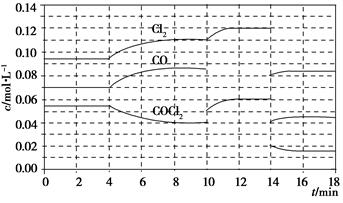
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com