
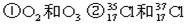 ③H2O和 D2O
③H2O和 D2O 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
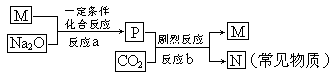
| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA H++A- H++A- | K1 | △H1 | 3.0×10-3 mol·L-1 |
在苯中,2HA (HA)2 (HA)2 | K2 | △H2 | 4.0×10-3 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pt与
Pt与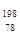 Pt的说法正确的是
Pt的说法正确的是A. Pt与 Pt与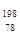 Pt是同一种核素 Pt是同一种核素 | B.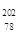 Pt与 Pt与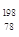 Pt的质量数相同 Pt的质量数相同 |
C.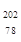 Pt与 Pt与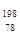 Pt互为同位素 Pt互为同位素 | D.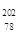 Pt与 Pt与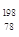 Pt的中子数均为78 Pt的中子数均为78 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
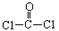 每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在氧化还原反应中,甲得电子比乙得电子多 |
| B.甲的最高价氧化物对应水化物酸性比乙的的最高价氧化物对应水化物酸性强 |
| C.甲的氢化物水溶液酸性比乙的氢化物水溶液酸性强 |
| D.向含甲和乙的阴离子的钠盐混合溶液中通入氯气,乙的阴离子先反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com