
 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0分析 ①醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
②生成氢气的体积取决于电离出的氢离子的量的多少;
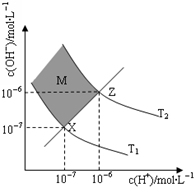
③在XZ线上的点,c(H+)=c(OH-),XZ线以上的区域c(H+)<c(OH-);
④根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和HCl溶液的体积.
解答 解:(1)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:bcf;
②醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,等体积且pH均等于3的醋酸和盐酸溶液中,醋酸的浓度大,所以醋酸产生的氢气体积较大
故答案为:小于;
③在XZ线上的点,c(H+)=c(OH-),XZ线以上的区域c(H+)<c(OH-),即M区域内(阴影部分)任意点c(H+)小于c(OH-),故答案为:小于;
④T℃时水的d离子积为10-12,所得混合溶液的pH=7,溶液呈碱性,氢氧根离子浓度为10-5mol/L,则$\frac{V(NaOH)×1{0}^{-3}-V(HCl)×1{0}^{-4}}{V(NaOH)+V(HCl)}$=10-5mol/L,解得V(NaOH):V(HCl)=1:9,
故答案为:1:9.
点评 本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键,侧重于考查学生的分析能力和计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.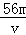 mol/L B.
mol/L B.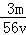 mol/L C.
mol/L C.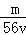 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HB-+A-═HA+B2- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | H3C+3OH-═3H2O+C3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
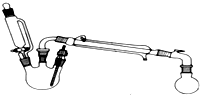 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com