
(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH=+8. 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH=+90. 4 kJ·mol-1 |
方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
|
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
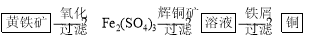
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下列物质性质与应用关系的描述正确的是
A.稀硝酸具有强酸性,实验室可用其制取少量氢气
B.铝具有强氧化性,生产上可用铝热反应制取一些金属
C.氢氧化铝具有两性,医疗上可用其治疗胃酸过多
D.钠具有强还原性,可用其与硫酸铜溶液反应来制取铜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:推断题
(18分)W结构中含有三个六元环,是一种新型香料的主要成分之一。W的合成路线如下(部分产物和部分反应条件略去):
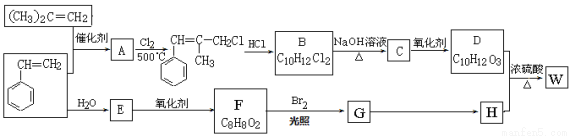
已知:①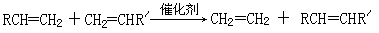
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和H是同系物
请回答下列问题:
(1)G分子中含有的官能团名称:___________________。
(2)A→B反应过程中涉及的反应类型有________________、_____________________ 。
(3)A的结构简式为___________________________;W的结构简式:_____________________________。
(4)G→H反应条件为______________________________ 。
(5)B→C的化学方程式:____________________;由D生成高分子化合物的方程式________________。
(6)同时满足下列条件的F的同分异构体有____________种(不包括立体异构):①能发生银镜反应;②能发生水解反应;其中核磁共振氢谱为5组峰的为_________(写结构简式),其峰面积之比为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
化学与人类生产,生活密切相关。下列有关说法不正确的是
A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
B.福尔马林可浸制标本,利用了其使蛋白质变性的性质
C.医用酒精使用淀粉类植物发酵经蒸馏制成,浓度通常为75%
D.绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,N表示粒子数。下列说法正确的是
A.0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA
B.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA—N(Cl2)]
C.一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA
D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的X和Y,发生反应:x(g)+aY(g) 2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
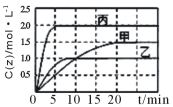
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.0molX 0.5molY | 1.0molX 0.5molY | 4.0molX 2.0molY |
A.该反应温度升高,平衡常数减小
B.20min内甲容器中反应的平均速率: v(X) = 0.075mol·(L·min)-1
C.其他条件不变,若缩小乙的体积,Y的转化率不变
D.10min时,其他条件不变,向乙容器中再加入2 molZ,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:推断题
(16分)从有机物A开始有如图所示的转化关系(部分产物略去)。 A在NaOH溶液中水解生成B、C和D,1mol F与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2mol红色沉淀。分析并回答问题:
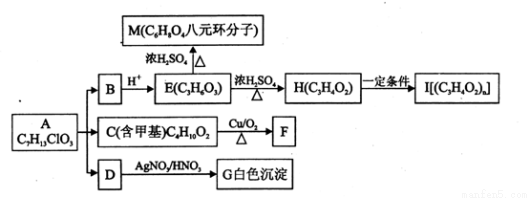
(1)A中含有的官能团有羟基、 (填写官能团名称)
(2)C的名称(系统命名)是 ;E—H的反应类型是 ;M的核磁共振氢谱有 组峰。
(3)C→F的化学方程式是 。
(4)F与足量新制Cu(OH)2反应的化学方程式是 。
(5)所有满足上述转化关系的A的结构简式是 。
(6)E的某同系物甲(C4H8O3)有多种同分异构体,其中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上的同分异构体有 种。(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<O,则该反应能自发进行
B.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3 d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东肥城市高三一模理综化学试卷(解析版) 题型:选择题
如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
A | C | |
B |
A.B在第三周期ⅦA族
B.C元素单质是氧化性最强的非金属单质
C.A与C的气态氢化物相比,稳定性与溶液的pH:A<C
D.最高价氧化物对应的水化物的酸性:C>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com