
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

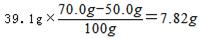 ,又初始加入的物质为
,又初始加入的物质为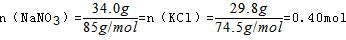 ,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。
,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。

科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验内容 | 结论 |
| A | 某气体的水溶液能使红色石蕊试纸变蓝 | 该气体一定是NH3 |
| B | 某气体能使紫色的酸性高锰酸钾溶液褪成无色 | 该气体一定是SO2 |
| C | 某物质的水溶液中加入盐酸产生能使澄清石灰水变浑浊的无色气体 | 该溶液一定含有CO32- |
| D | 某物质的水溶液中加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 该溶液中至少含有SO42-、SO32-中的一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲一定是氢氧化钙 | B.乙一定是硝酸钾溶液 |
| C.丙不可能是碳酸钠溶液 | D.丁只能是盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
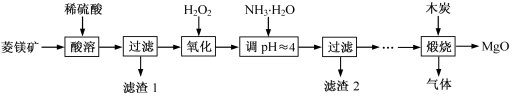
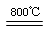 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgO+S↑+3CO↑
MgO+S↑+3CO↑
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A. | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
| B. | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中定含SO42- |
| C. | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
| D. | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.提纯NaCl和KNO3的混合物中的KNO3:加热蒸发、冷却结晶,过滤 |
| B.除去CO2中混有的少量CO:混合气体依次通过NaOH溶液和浓硫酸 |
| C.除去盐酸中混有的少量CaCl2:加入过量CaCO3粉末,过滤 |
| D.除去NaCl溶液中混有的少量I2:向混合溶液中加入适量CCl4,充分振荡,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com