
在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃发生反应:2SO2+O2 2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g
D.达到平衡时,SO2的转化率为90%
解析 SO3的生成速率与SO2的消耗速率都是正反应速率,两者相等时不能作为反应达到平衡的标志,A项错误;降低温度,逆反应(吸热反应)的化学反应速率下降的程度更大,B项错误;根据化学方程式可知,当气体的物质的量减少0.315 mol时,消耗O2的物质的量为0.315 mol,消耗SO2的物质的量和生成SO3的物质的量均为:2×0.315 mol=0.63 mol,混合气体中,只有SO3能与BaCl2溶液反应,m(BaSO4)=233 g·mol-1×0.63 mol=146.79 g,C项错误;气体的压强之比等于气体的物质的量之比,设反应开始时,n(SO2)=x mol,则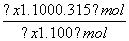 ×100%=82.5%,得x=0.7 mol,达到平衡时,SO2的转化率为
×100%=82.5%,得x=0.7 mol,达到平衡时,SO2的转化率为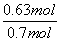 ×100%=90%,D项正确。
×100%=90%,D项正确。
答案 D


科目:高中化学 来源: 题型:
将a g聚苯乙烯树脂溶于b L苯中,然后通入c mol乙炔气体,所得混合液中C、H两元素的质量比为( )
A.6:1 B.12:1
C.1:1 D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如下图所示装置的叙述正确的是( )
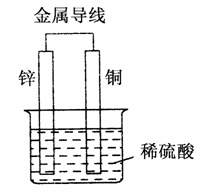
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是( )
A.c1c2=13
B.平衡时,Y和Z的生成速率之比为23
C.X和Y的转化率相等
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
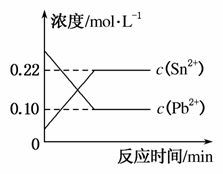
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示。
| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800°C | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800°C | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800°C | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820°C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列空白:
(1)在实验1中,反应在10 min~20 min内平均反应速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡状态,可推测实验2中还隐含的条件是______________________。
(3)设实验3的反应速率为ν3,实验1的反应速率为ν1,则ν3________ν1(填“>”“=”或“<”),且c3________1.0 mol·L-1(填“>”“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是________(填“吸热”“放热”)反应;理由是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用 ②研发易降解的生物农药 ③应用高效洁净的能源转化技术 ④田间焚烧秸秆 ⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2 ·zH2O)的组成可通过下列实验测定:①准确称取1. 7700 g样品,配制成100. 00 mL溶液A。②准确量取25. 00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 g。③准确量取25. 00 mL溶液A,加适量稀硫酸酸化后,用0. 02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25. 00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4- +5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp =1. 1×10-10,欲使溶液中c(SO42-)≤1. 0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4- 被还原为MnO2,其离子方程式为
(3)上述滴定到达终点的现象为
(4)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com