

分析 (1)由图及常见仪器可知仪器的名称;
(2)具有塞子、活塞的仪器使用时需要检查是否漏水;
(3)用装置I分离四氯化碳和酒精的混合物,利用沸点差异分离,需要测定温度;
(4)配制250mL、0.2mol/LNaCl溶液,应选择相应规格的容量瓶,且转移液体需要引流.
解答 解:(1)由图可知,仪器①④分别为蒸馏烧瓶、1000mL容量瓶,故答案为:蒸馏烧瓶;1000mL容量瓶;
(2)具有塞子、活塞的仪器使用时需要检查是否漏水,则仪器①~④中,使用时必须检查是否漏水的是④,故答案为:④;
(3)用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有温度计,将仪器补充完整后进行的实验操作的名称为蒸馏,故答案为:温度计;蒸馏;
(4)配制250mL、0.2mol/LNaCl溶液,应选用250mL容量瓶,且转移液体时没有用玻璃棒引流,故答案为:没选用250mL容量瓶;没有用玻璃棒引流.
点评 本题考查混合物分离提纯实验设计,为高频考点,把握仪器的使用、混合物分离提纯、溶液配制等为解答的关键,注意实验装置的作用及实验技能,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④②③① | C. | ④①②③ | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
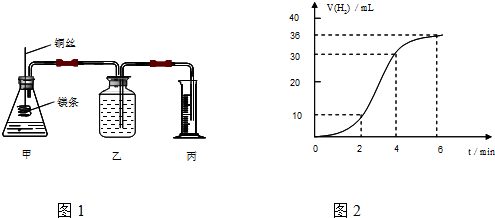
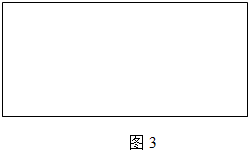
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
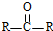 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$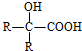 (R、R′代表烃基)
(R、R′代表烃基)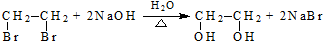
 .
.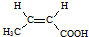 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2则△H1<△H2 | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 已知中和热为△H=-57.3kJ•mol-1,则稀醋酸和稀NaOH溶液反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
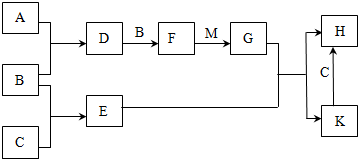
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 加入新制的生石灰,再加热蒸馏,可以除去乙醇中的少量水 | |
| D. | Mg(OH)2中混有少量Al(OH)3,加入足量烧碱溶液,充分反应,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com