
 A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ������������������ B��Cͬ���ڣ�D��E��Fͬ���ڣ�A��D ͬ���壬C��Fͬ���壬CԪ�ص�ԭ�������������Ǵ�������������������֪����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壮
A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ������������������ B��Cͬ���ڣ�D��E��Fͬ���ڣ�A��D ͬ���壬C��Fͬ���壬CԪ�ص�ԭ�������������Ǵ�������������������֪����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壮���� A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ��������������CԪ�ص�ԭ�������������Ǵ�����������������ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����C��OԪ�أ�C��Fͬ���壬��F��SԪ�أ�D��E��Fͬ���ڣ������ڵ������ڣ�D��E��ԭ��������С����D��E�ĵ���Ϊ���壬����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壬��A��B����Ϊ���壬A��Bԭ������С�ھ�С������B��Cͬ���ڣ���AΪHԪ�ء�BΪNԪ�أ�A��D ͬ���壬��DΪNaԪ�أ���EΪ��ǿ����Һ�ܷ�����Ӧ�Ľ���Ԫ�أ���EΪAl���ݴ˽��
��1 �����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ��
��2 ��N2H 4����O2��KOH��Һ�γ�ԭ��أ�N2H4��O2 ��Ӧ����N2��H2O�������ԭ��طŵ�ʱ����������������Ӧ��N2H4ʧȥ���Ӽ������������ɵ�����ˮ��
�ø�ԭ����ṩ�������ö��Ե缫��� 200mL1mol•L-1CuSO4��Һ������ͭ����Ϊ0.2L��1mol/L=0.2mol�������� 0.2molN2H 4ʱ��ת�Ƶ���Ϊ0.2mol��2��2=0.8mol��ͭ������ȫ�ŵ���Ҫ����Ϊ0.2mol��2=0.4mol��0.8mol�������������ӻ��ŵ���������������ֻ���������ɣ����ݵ���ת���غ������������Ϊ$\frac{0.8mol}{4}$=0.2mol���ټ���Cu���������ʵ����������ж���Ҫ�������ʼ���������
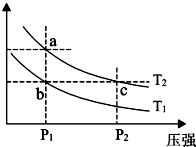
��3��A��a��c���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻
B��c��ѹǿ��������ѹǿƽ�������ƶ�����������ת��������
C��a��c���㶼�ڵ������ϣ�c��ѹǿ����c�����������Ũ�ȸ�����ɫ���a��b����ѹǿ��ȣ�a����������ĺ�������a��Ũ�ȱ�b��Ũ�ȴ�
D�������¶ȣ���ѧƽ�����������ƶ���NO2�������������
��4 ������1Ħ��������Ӧ�ų���������ע�����ʾۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��5 ����H��O��Na��S����Ԫ���γɵĻ�����NaHSO 3����֪ H2 SO3�� Ka1=1.3��10-2��Ka2=6.3��10-8������HSO3-��ˮ��ƽ�ⳣ������������Ķ�������ƽ�ⳣ���Ƚϣ��ж�HSO3-�ĵ���̶���ˮ��̶���Դ�С�������ж���Һ������ԣ����ˮ�ĵ��롢���������ˮ��������жϣ�
�����£������Һ�м���һ������NaOH��ʹ��Һ�� c �� HSO3- ��=c �� SO32-�������ݵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-���������ж�c��H+����c��OH-����
��� �⣺A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ��������������CԪ�ص�ԭ�������������Ǵ�����������������ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����C��OԪ�أ�C��Fͬ���壬��F��SԪ�أ�D��E��Fͬ���ڣ������ڵ������ڣ�D��E��ԭ��������С����D��E�ĵ���Ϊ���壬����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壬��A��B����Ϊ���壬A��Bԭ������С�ھ�С������B��Cͬ���ڣ���AΪHԪ�ء�BΪNԪ�أ�A��D ͬ���壬��DΪNaԪ�أ���EΪ��ǿ����Һ�ܷ�����Ӧ�Ľ���Ԫ�أ���EΪAl��
��1 �����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶��S2-��O2-��Na+��Al3+��
�ʴ�Ϊ��S2-��O2-��Na+��Al3+��
��2 ����A��B����Ԫ���γɵĻ�����N2H 4����O2��KOH��Һ�γ�ԭ��أ�N2H4��O2 ��Ӧ����N2��H2O�������ԭ��طŵ�ʱ����������������Ӧ�������ĵ缫����ʽΪ��N2H4-4e-+4OH-=N2+4H2O��
�ø�ԭ����ṩ�������ö��Ե缫��� 200mL1mol•L-1CuSO4��Һ������ͭ����Ϊ0.2L��1mol/L=0.2mol�������� 0.2molN2H 4ʱ��ת�Ƶ���Ϊ0.2mol��2��2=0.8mol��ͭ������ȫ�ŵ���Ҫ����Ϊ0.2mol��2=0.4mol��0.8mol�������������ӻ��ŵ���������������ֻ���������ɣ����ݵ���ת���غ㣬��������Ϊ$\frac{0.8mol}{4}$=0.2mol����������CuΪ0.2mol����������Ϊ$\frac{0.8mol-0.2mol��2}{2}$=0.2mol���൱������0.2mol
��Cu��OH��2����Ҫʹ���Һ�ָ������ǰ���������Ҫ�����м���0.2mol Cu��OH��2��������Ϊ0.2mol��98g/mol=19.6g��
�ʴ�Ϊ��N2H4-4e-+4OH-=N2+4H2O��19.6g��Cu��OH��2��
��3��A����ͼ���֪��a��c���㶼�ڵ������ϣ�c��ѹǿ����a��c����ķ�Ӧ���ʣ�a��c����A����
B��c��ѹǿ��������ѹǿƽ�������ƶ�����������ת��������NO2��ת���ʣ�a��c���ʹ�B����
C��a��c���㶼�ڵ������ϣ�c��ѹǿ����c�����������Ũ�ȸ�����ɫ���a��b����ѹǿ��ȣ�a����������ĺ�������a��Ũ�ȱ�b��Ũ�ȴ�c����������Ũ�������ɫ�����c����
D�������¶ȣ���ѧƽ�����������ƶ���NO2�������������b�㵽a�����������������������ü��ȵķ���ʵ����b�㵽a���ת�䣬��D��ȷ��
��ѡ��D��
��4 ��500�桢30MPa�£������͵��������ܱ������г�ַ�Ӧ���� NH3��g ��������1.5mol������0.5mol�������ʣ�������46kJ����÷�Ӧ���Ȼ�ѧ����ʽΪ��N2 ��g��+3H2��g��=2 NH3��g����H=-92kJ•mol-1��
�ʴ�Ϊ��N2 ��g��+3H2��g��=2 NH3��g����H=-92kJ•mol-1��
��5 ����H��O��Na��S����Ԫ���γɵĻ�����NaHSO 3����֪ H2 SO3�� Ka1=1.3��10-2��Ka2=6.3��10-8����HSO3-��ˮ��ƽ�ⳣ��=$\frac{1{0}^{-14}}{1.3��1{0}^{-2}}$=7.7��10-13��6.3��10-8����HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ���Һ�����ԣ���Һ��������Դ��ˮ���롢HSO3-�ĵ��룬����Һ�и�����Ũ���ɴ�С��˳��Ϊ��c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-���������£������Һ�м���һ������NaOH��ʹ��Һ�� c �� HSO3- ��=c �� SO32-�������ݵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-������c��H+��=c��SO32-��+c��OH-������c��H+����c��OH-������Һ�����ԣ�
�ʴ�Ϊ��c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-�������ԣ�
���� ���⿼��ṹ����λ�ù�ϵӦ�á�ԭ���������㡢��ѧƽ��ͼ���Ȼ�ѧ������д������ƽ�ⳣ����ԭ��ˮ��ȣ��ƶ�Ԫ���ǽ���ؼ����ۺϿ���ѧ��������������������������֪ʶ��Ǩ�����ã���Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ӻ�ˮ���Ƶ�ˮ | B�� | ������������ȡ������ | ||
| C�� | �ڸ�������������մ� | D�� | ��ʯ�ʹ��ѽ�����ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��չ�� | C�� | ���۵� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | C�� | �Ȼ��� | D�� | ����þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ʳ��ˮ���Եõ� NaCl ���壬�������� AlCl 3 ��ҺҲ���Եõ� AlCl 3 ���� | |
| B�� | ����Ũ�Ⱦ�Ϊ 0.1mol•L-1 ��H3PO4 �� H2SO4 ��Һ���ֱ����pH���� H3PO 4��Һ��pH���� H2SO4 ��Һ��pH�����Ƴ��ǽ����ԣ�S��P | |
| C�� | NaHCO3 ��Һ�е����̪�Ժ�ɫ��NaHSO4 ��Һ�е����̪Ҳ�Ժ�ɫ | |
| D�� | ����������ȼ�����ɹ������ƣ�����ͬ��������������ȼ��Ҳ���ɹ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ����Һ��Fe3+���ʵ���Ϊ0.8mol | |
| B�� | ��Ӧ�����13.44L H2����״���� | |
| C�� | ��Ӧ����Һ��Fe2+��Fe3+���ʵ���֮��Ϊ0.9mol | |
| D�� | ����������Fe3+��H+���ʷ�Ӧ����û������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܱ��������������������� | |
| B�� | FeCl2����ͨ�����������Ļ��Ϸ�Ӧ�õ� | |
| C�� | ȱ����ƶѪ�������ָ��Ԫ�� | |
| D�� | ��ҵ�ϳ�������ʯ�������ڸ�¯�ڷ�Ӧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3OH��ȼ����Ϊ1452kJ•mol-1 | |
| B�� | 2H2��g��+O2��g���T2H2O��g����H��-571.6kJ•mol-1 | |
| C�� | 2CH3OH��l��+O2��g���T2CO2��g��+4H2��g����H=-880.4kJ•mol-1 | |
| D�� | CH3COOH��aq��+NaOH��aq���TH2O��l��+CH3COONa��aq����H=-57.3kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com