
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
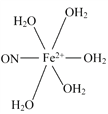
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

【答案】[物质结构与性质]
(1)sp3 平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO2
(4)1∶2
(5)
【解析】分析:(1)用价层电子对互斥理论分析SO42-中S的杂化方式和NO3-的空间构型。
(2)Fe原子核外有26个电子,根据构造原理写出基态Fe的核外电子排布式,进一步写出Fe2+的核外电子排布式。
(3)用替代法写出O3的等电子体。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键。
N,三键中含1个σ键和2个π键。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子。
详解:(1)SO42-中中心原子S的价层电子对数为![]() (6+2-4
(6+2-4![]() 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为
2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子,答案为: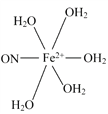 。
。


科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2 气体和 SO3 气体相比较,下列叙述中正确的是
A. 物质的量之比为 4:5 B. 密度比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. MgCl2的摩尔质量为95g
B. 18g H2O含有的原子总数为3NA
C. 0.5mol H2所占体积约为11.2L
D. 0.1 mol·L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
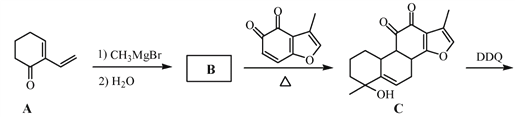
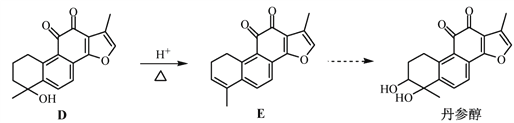
已知:![]()
(1)A中的官能团名称为__________________(写两种)。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)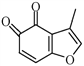 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和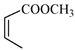 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。

回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,乙装置中品红溶液褪色,说明SO2具有_________性,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性。
(3)丁装置中发生主要反应的化学方程式:____________________________________________;其作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置电解硫酸铜和氯化钠的混合溶液,当线路中有1.20mol电子通过时,甲电极增重并有4.48L(已折算成标准状况下的体积,后同)气体生成,乙电极同时生成气体7.84L,则原溶液中硫酸铜与氯化钠的物质的量之比为
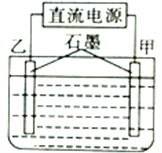
A. 2:1 B. 4:1 C. 2:3 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种工业化工原料。无色透明的带刺激性臭味的液体,在潮湿空气中剧烈发烟。某化学小组采用PCl3氧化法制备POCl3。已知:POCl3的熔点为-112℃,沸点为75.5℃。在潮湿空气中二者均极易水解面剧烈“发烟”。回答下列问题:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制取氯气。发生装置可以选择图中的_____(填字母代号)。
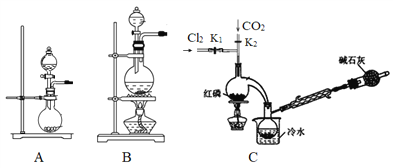
(2)检查装置气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。通干燥CO2的作用是_______。
II.制备POCl3(如图)
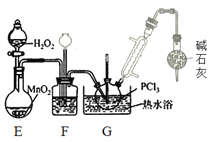
(3)盛放碱石灰的仪器的作用是________,装置G中发生反应的化学方程式为________ 。
(4)装置F的作用除观察O2的流速之外,还有________。
III.测定POCl3含量
实验制得的POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度:
①快速称取5.000g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/LNa2S2O3溶液8.00mL.
已知:H3PO3+I2+H2O==H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6.
(5)滴定终点的现象为__________。该产品的纯度为________。
(6)若滴定管在滴定前无气泡,滴定后有气泡,则测定结果______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯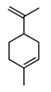 )。提取柠檬烯的实验操作步骤如下:
)。提取柠檬烯的实验操作步骤如下:
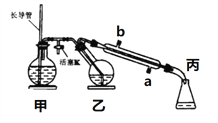
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,为防止倒吸,立即停止加热
C. 长玻管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D. 要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com