
【题目】人造骨是一种新型的无机非金属材料,它类似于人骨和天然牙的性质结构,这是利用了这类材料的生物特性。人造骨可以依靠从人体体液中补充某些离子而形成新骨,可在骨骼界面产生分解、吸收、析出等反应,实现骨骼的牢固结合。人造骨植入人体内需要吸收人体中哪些离子才可以形成新骨( )
A. Ca2+ B. Cl- C. Na+ D. PO43-
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
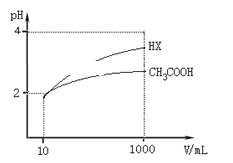
则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H7ClO2的同分异构体甚多, 其中能与 NaHCO3发生反应产生CO2的同分异构体共有(不考虑立体异构)
A.3种B.4种C.5种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A,在一定条件下发生反应:xA(g)![]() yB(g)+pC(g)+qD(g)。已知:平均反应速率
yB(g)+pC(g)+qD(g)。已知:平均反应速率![]() ;反应至2min时,A的物质的量减少为起始时的
;反应至2min时,A的物质的量减少为起始时的![]() ,生成B、D的物质的量分別为
,生成B、D的物质的量分別为![]() a mol、a mol。回答下列问题:
a mol、a mol。回答下列问题:
(1)0~2min内,![]() __________________。
__________________。
(2)该反应的化学方程式为_________________________________________。
(3)反应xA(g)![]() yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
①A(g)的消耗速率与C(g)的生成速率之比为x:p
②A(g)的物质的量保持恒定
③A(g)的消耗速率与D(g)的消耗速率之比为q:x
④B(g)和C(g)的物质的量之比为y:p
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则m、n应满足的关系为__________(用含m、n的等式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳和硅的叙述不正确的是( )
A. 最高价氧化物都能与氢氧化钠溶液反应 B. 单质在加热时都能与O2反应
C. 氧化物都能与水反应生成相应的酸 D. 在常温下,单质的化学性质都不活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)C在周期表中的位置____________________;
(2)由A、B、C三种元素形成的离子化合物的化学式为______________________。
(3)元素C、D、E形成的离子半径大小关系是___________________(用离子符号表示).
(4)用电子式表示化合物D2C的形成过程____________________________________。
C、D还可形成化合物D2C2,D2C2含有的化学键是_____________________________。其主要用途有______________________。
(5)现有空气中加热片刻生成的D的氧化物(假定全为D2C2和D2C的混合物)a克,与VLHCl反应至中性,则HCl的浓度取值范围为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com