
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳塑料是通过加聚反应制得的 | |
| B. | 用上业废弃物二氧化碳生产塑料,有助于缓解温室效应 | |
| C. | 二氧化碳塑料不能在空气中燃烧 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
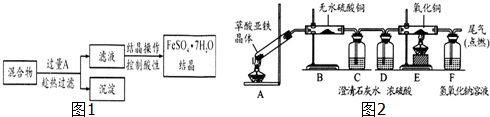
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是电解质的可能性大 | B. | X不可能是非电解质 | ||
| C. | X只能是盐类 | D. | X可以是任意化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com