
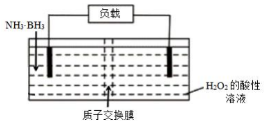
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |
分析 以氨硼烷(NH3•BH3)电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O可知,左侧NH3•BH3为负极失电子发生氧化反应,电极反应式为NH3•BH3+2H2O-6e-=NH4BO2+6H+,右侧H2O2为正极得到电子发生还原反应,电极反应式为3H2O2+6H++6e-═6H2O,据此分析.
解答 解:A.电流从正极流向负极,即从右侧电极经过负载后流向左侧电极,故A错误;
B.放电时,阴离子向负极移动,所以BO2-通过质子交换膜向负极移动,故B错误;
C.NH3•BH3为负极失电子发生氧化反应,电极反应式为NH3•BH3+2H2O-6e-=NH4BO2+6H+,所以负极附近溶液pH减小,故C错误;
D.右侧H2O2为正极得到电子发生还原反应,电极反应式为3H2O2+6H++6e-═6H2O,故D正确;
故选D.
点评 本题考查了原电池原理,涉及电极反应式的书写、电极的判断、离子移动方向等知识点,难点是电极反应式的书写,要结合电解质溶液书写,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | K+、Na+、SO32-、S2- | ||
| C. | K+、Na+、AlO2-、SO42- | D. | Ba2+、Fe2+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴:一般需要经过浓缩、氧化、提取三个步骤 | |
| B. | 合成氯化氢:通入H2的量略大于C12,可以使平衡正移 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
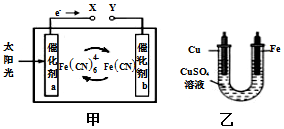 甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )
甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )| A. | 电池工作时,K+移向电极a | |
| B. | 电极b表面发生的电极反应Fe(CN)64--e-═Fe(CN)63- | |
| C. | Cu电极应与Y相连接,发生氧化反应 | |
| D. | 工作一段时间后,甲乙两装置中电解质溶液浓度均变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
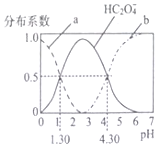 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )| A. | 曲线a代表H2C2O4,曲线b代表C2O42- | |
| B. | 常温下0.1mol/L的NaHC2O4溶液显酸性 | |
| C. | 常温下,H2C2O4的电离平衡常数Ka2=10-4..30 | |
| D. | pH从1.30~4.30时,$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向二氧化锰固体中加入浓盐酸后加热,将产生的气体通入淀粉碘化钾溶液液 | 溶液变蓝 | Cl2具有氧化性 |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水 | 溴水褪色 | SO2具漂白性 |
| C | 向蔗糖溶液中加稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 溶液变蓝 | 蔗糖水解产物没有还原性 |
| D | 无水乙醇与浓硫酸共热170℃,将产生的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 乙烯可被化酸性高锰酸钾氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com