
【题目】常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液pH与V(NaOH)的关系如图1;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下述正确的是 ( )
图1  图2
图2
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
【答案】C
【解析】
A.Mg的金属性强于Al,Mg(OH)2的碱性强于Al(OH)3,浓度相同的Mg2+水解程度小于Al3+,V(NaOH)=0时,相同浓度的镁铝离子溶液中MgSO4pH大,故图1中的曲线I表示MgSO4与NaOH反应的关系,与题意不符,A错误;
B.图1中(5,3.5)点时溶液中c(H+)=10-3.5mol/L,c(OH-)=10-10.5mol/L,若铝离子未反应,则c(Al3+)=![]() =0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
=0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
C.由图1可知,Al3+先沉淀,Mg2+后沉淀,并且pH=5时Al3+沉淀完全,pH=9时Mg2+开始沉淀、Al(OH)3开始溶解,实验②溶液中,随着NaOH的加入,Al3+先沉淀到完全、再溶解,所以Al(OH)3完全溶解前,溶液中c(Mg2+):c(Al3+)逐渐增大,符合题意,C正确;
D.25mL实验②溶液中n(Al3+)=n(Mg2+)=0.5×25×10-3L×0.1mol/L=1.25×10-3mol,由Al3+~Al(OH)3~3OH-可知,Al3+完全沉淀时消耗V(NaOH)=1.25×103mol×3×0.5mol/L=7.5mL,再加入5mlNaOH即加入NaOH总体积为12.5mL时,溶液中c(OH-)=5×0.5×103mol×(25+7.5+5)×103L=0.067mol/L,pH≈12.8>9,此时Al(OH)3几乎溶解完全、Mg(OH)2几乎沉淀完全,所以加入NaOH体积大于7.5ml时,Al(OH)3开始溶解而减少、Mg(OH)2沉开始淀,所以实验②中n(沉淀)与V(NaOH)的关系不是直线上升的关系,即不能表示实验②中n(沉淀)与V(NaOH)的关系,与题意不符,D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___,该配离子的空间构型为___;CN-中配位原子是___(填名称)。
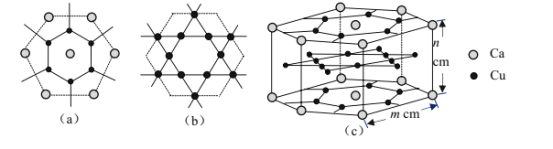
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___g/cm3(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A. 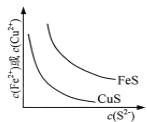 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B. 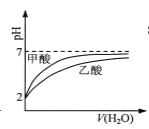 pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 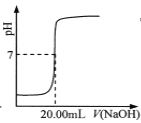 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 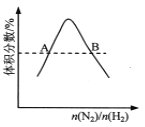 反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行Fe2+与Fe3+转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
(1)该小组对于产生气体的原因有两种猜测:
猜测一:__________________________________________。
猜测二:红色褪去可能是SCN-被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫。
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
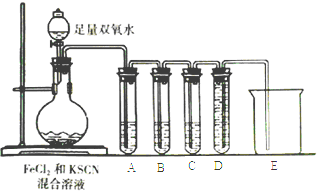
①试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有____________;
②试管B中的溶液是酸性高锰酸钾溶液,其目的是________________,预期试管B中的现象是________________________________。
③试管C中盛有澄清石灰水,目的是___________________;试管D和烧杯的作用是______________。④以上实验证明SCN-能被H2O2氧化.请写出该反应的离子方程式:___________________________________。
(3)根据题目信息及以上实验推断,Fe2+和SCN-中还原性较强的是_______,理由是_________。
(4)有人认为SCN-的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )

A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将2molA和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:K=___。已知K300℃<K350℃,则ΔH__0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为___,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率___(填“增大”“减小”或“不变”),原因是___。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
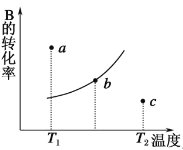
A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:
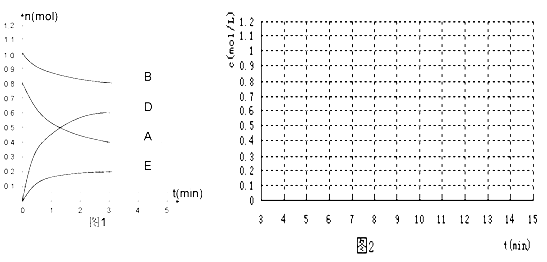
mA(g)+nB(g)![]() pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为____________ mol/(L·min);方程式中m:n:p:q =________________
(2)该反应的化学平衡常数K为_________________(保留至一位小数);
(3)下列措施能增大B的转化率的是 ( )
A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E. 保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是( )
A.恒容恒温时容器中气体压强保持不变
B.混合气体中D浓度不变
C.v(A)正 = v(A)逆
D.恒容时容器中气体密度不变
(5)反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出第7 min至第15 min(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4 mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com