
工业上制备纯硅的热化学反应方程式为:SiCl4(g) + 2H2(g)Si(s) + 4HCl(g);△H = + Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高硅的产率
B.若反应开始时H2为2 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl的浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中能恰好完全反应
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(带解析) 题型:填空题
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②平衡时容器内N2的浓度是 mol·L-1。
③SiCl4(g)的转化率是 。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2014届北京市高二下学期期中考试化学试卷(解析版) 题型:填空题
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) +
12HCl(g) △H<0
Si3N4(s) +
12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②平衡时容器内N2的浓度是 mol·L-1。
③SiCl4(g)的转化率是 。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)
 Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还
原法。由于三氯氢硅还原法具有一定优点,被广泛应用。其简化的工艺流程如图所示:
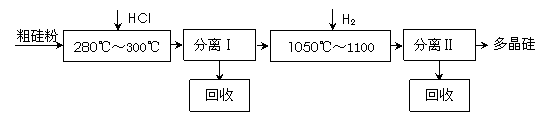 |
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g) == SiHCl3(g)+H2(g) ΔH=-210 kJ•mol-1。
伴随的副反应有:Si(s)+4HCl(g) == SiCl4(g)+2H2(g) ΔH=-241 kJ•mol-1。
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
![]() SiCl4(g)+H2(g) == SiHCl3(g)+HCl(g) ΔH= 。
SiCl4(g)+H2(g) == SiHCl3(g)+HCl(g) ΔH= 。
(2)由纯SiHCl3制备高纯硅的化学反应方程式为 。该生产工艺中可以循环使用的物质是 (至少写出两种)。
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是 ;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为 ;整个系统还必须与氧隔绝,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com