
【题目】如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等试验的装置示意图
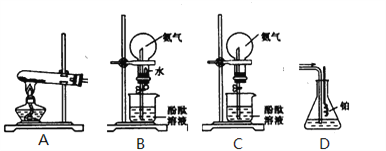
请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________________;制出的氨气应使用________法来收集,要得到干燥的氨气可选用___________作干燥剂。
(2)学生乙用图B所示装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是________。
(3)学生丙将装置B误装为装置C,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法____________________。
(4)学生丁用装置D吸收一段时间氨气后,再通入空气,同时将经加热的铂丝插入装置D的锥形瓶内,看到了具有催化作用的铂丝(催化剂)保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式________________________,____________________________.
【答案】 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 向下排空气法 碱石灰 打开止水夹,把胶头滴管中的液体挤入圆底烧瓶中 用热毛巾捂住圆底烧瓶底部,使烧瓶中气体进入烧杯中,撤去热毛巾,烧杯中液体进入烧瓶 4NH3+5O2
CaCl2+2NH3↑+2H2O 向下排空气法 碱石灰 打开止水夹,把胶头滴管中的液体挤入圆底烧瓶中 用热毛巾捂住圆底烧瓶底部,使烧瓶中气体进入烧杯中,撤去热毛巾,烧杯中液体进入烧瓶 4NH3+5O2![]() 4NO+6H2O 2NO+O2=2NO2
4NO+6H2O 2NO+O2=2NO2
【解析】考查实验方案设计与评价,(1)根据装置A的特点,选用的药品应为固体,即制备氨气的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O氨气极易溶于水,且氨气的密度小于空气,因此采用向下排空气法收集,干燥氨气应用碱石灰或生石灰;(2)引发喷泉的操作是打开止水夹,把胶头滴管中的液体挤入圆底烧瓶中;(3)先打开止水夹,然后让烧瓶中气体膨胀,与烧杯中的溶液接触,造成容器内的压强减小,因此具体操作是打开止水夹用热毛巾捂住圆底烧瓶底部,使烧瓶中气体进入烧杯中,撤去热毛巾,烧杯中液体进入烧瓶;(4)此实验应是氨的催化氧化,其反应方程式为4NH3+5O2
CaCl2+2NH3↑+2H2O氨气极易溶于水,且氨气的密度小于空气,因此采用向下排空气法收集,干燥氨气应用碱石灰或生石灰;(2)引发喷泉的操作是打开止水夹,把胶头滴管中的液体挤入圆底烧瓶中;(3)先打开止水夹,然后让烧瓶中气体膨胀,与烧杯中的溶液接触,造成容器内的压强减小,因此具体操作是打开止水夹用热毛巾捂住圆底烧瓶底部,使烧瓶中气体进入烧杯中,撤去热毛巾,烧杯中液体进入烧瓶;(4)此实验应是氨的催化氧化,其反应方程式为4NH3+5O2![]() 4NO+6H2O,因为NO能与空气中氧气发生反应,生成NO2,即反应方程式为2NO+O2=2NO2。
4NO+6H2O,因为NO能与空气中氧气发生反应,生成NO2,即反应方程式为2NO+O2=2NO2。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O==HBr+HIO。下列有关IBr的叙述中,不正确的是
A. IBr的电子式:![]()
B. IBr和Zn的反应化学方程式2IBr+2Zn==ZnI2+ZnBr2
C. IBr和NaOH溶液反应生成NaBr和NaIO
D. IBr和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
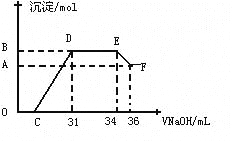
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____ __
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ _ ,上述现象说明溶液中_____ _结合OH—的能力比___ ___强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。
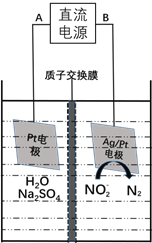
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为S+2KNO3+3C===K2S+N2↑+3CO2↑。该反应中还原剂是( )
A. C B. KNO3 C. S D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色.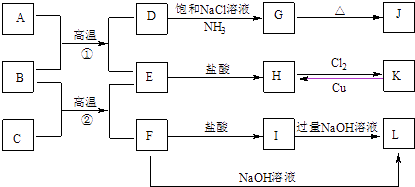
请回答下列问题:
(1)G的化学式为 , D的电子式为 .
(2)F→L反应的化学方程式为 .
(3)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法不正确的是( )
A.冰融化成水放出热量
B.化学键断裂过程一定放出能量
C.生成物的总能量一定低于反应物的总能量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2+Cl2![]() 2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
A.反应后所得气体比相同状况下空气的密度大
B.反应后所得气体在标准状况下的体积为6.72L
C.反应后所得气体中H原子和Cl原子的物质的量之比为1:2
D.反应后所得气体可被100mL 1mol/L NaOH溶液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不做氧化剂,又不做还原剂的是( )
A.Cl2+H2O=HCl+HClO
B.2K+2H2O=2KOH+H2↑
C.2F2+2H2O=4HF+O2
D.Na2O+H2O=2NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com