
| A | B | C | D | |
| 方案 |  | 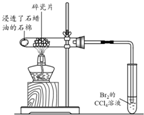 |  | 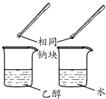 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.利用乙醇的消去反应制取乙烯反应在170℃下进行;
B.石蜡油分解生成的气体不全是乙烯;
C.乙烯、乙炔都能使酸性高锰酸钾褪色;
D.钠和水、乙醇反应剧烈程度不同.
解答 解:A.利用乙醇的消去反应制取乙烯反应在170℃下进行,应插入液面下,故A错误;
B.石蜡油分解生成的气体不全是乙烯,可能含有其它烯烃,如丙烯等,故B错误;
C.乙烯、乙炔都能使酸性高锰酸钾褪色,无法检验,故C错误;
D.水中氢氧根离子和乙醇中的羟基氢活泼性不同,与钠反应剧烈程度不同,和水反应剧烈,和乙醇反应缓慢,可以利用和钠反应判断水和乙醇中羟基氢的活泼性强弱,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、检验以及性质的比较等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
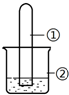 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去固体Na2CO3中的少量NaHCO3 | 将混合物加热充分反应 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
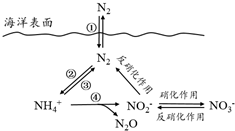 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(N2)=1.875×10-4mol•L-1•s-1 | |
| B. | 在该温度下,反应的平衡常数K=5 | |
| C. | 若将容积缩小为原来的一半,NO转化率大于90% | |
| D. | 使用催化剂可以提高单位时间CO和NO的处理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com